作者简介:徐惠娟(1971-),女,博士,副研究员,主要从事生物质生物转化燃料与化学品的研究。
热纤梭菌是一种高效的、能直接分解纤维素的嗜热厌氧菌,其转化纤维素的主要产物有乙醇、乙酸、乳酸、CO2和H2等,是目前最有希望实现纤维素转化工业化的菌株之一。本文综述了热纤梭菌转化木质纤维素产乙醇的相关研究,涉及热纤梭菌的代谢途径、纤维素降解机制及其在合成乙醇方面的最新进展。
Clostridium thermocellum is a thermophilic anaerobic bacterium which can efficiently decompose cellulose and produce ethanol, acetic acid, lactic acid, CO2 and H2. It is one of the most promising strains for commercial cellulose conversion. In this article, researches on lignocellulose conversion to ethanol by C. thermocellum, involving the metabolic pathways, the mechanism of cellulose degradation, as well as the latest progress on ethanol production were reviewed.
随着经济的高速发展和人口的快速增长, 全球化石能源的消费速度与日俱增。化石能源的不可再生性及其使用过程中产生CO2、SO2等导致全球酸雨、温室效应、臭氧层孔洞等一系列环境问题, 迫使人们寻找新的可替代能源。可再生的生物能源就是一个很好的替代能源, 根据目前全球生物能源领域的战略目标, 预计到2050年生物能源将占世界能源需求的30%[1]。在众多的生物能源中, 生物乙醇是一种优质的液体燃料, 具有灰分低和硫分低等特点, 可以添加到汽油中使用, 不仅能够提供与汽油相当的化学能, 还能提高汽油的抗爆性, 降低汽车尾气排放, 被认为是一种极具潜力的化石能源替代品[2]。
目前生物乙醇研究的热点是利用木质纤维素原料来生产乙醇, 因为木质纤维素原料储量极其丰富而且可以再生。而如何提高过程效率、降低生产成本是该技术研究的重点, 也是决定其能否实现产业化的关键。酿酒酵母或运动发酵单胞菌是用于乙醇发酵的主要微生物菌株, 但是它们不能分解高度聚合的木质纤维素, 需要通过纤维素酶将纤维素水解转化为单糖, 然后才能进一步发酵成乙醇, 这会降低过程的经济性。整合生物加工(consolidated bioprocessing, CBP)技术将纤维素酶的生产、纤维素的酶解和发酵几个过程整合在一起, 实现从纤维素原料到产物的直接转化, 能够简化生产工艺, 降低成本[3, 4], 因此在纤维素原料生物炼制中极具优势。CBP技术的关键是找到一种既能有效分解纤维素成寡糖又能进一步发酵糖类的微生物或微生物群落[5], 嗜热厌氧的热纤梭菌(Clostridium thermocellum)对木质纤维素有很强的降解能力, 并能发酵生成乙醇, 是CBP制纤维素乙醇的优良候选菌株, 受到科学家的广泛关注。本文对热纤梭菌的特性、降解纤维素机理及其在乙醇发酵方面的研究进展进行了综述。
热纤梭菌是一种嗜热产芽孢的严格厌氧菌, 在45 ~ 65℃之间可以生长, 最适生长温度55 ~ 60℃, 革兰氏染色阳性, 在显微镜下细胞呈杆状, 细胞外包裹着由肽聚糖、胞壁质等组成的细胞壁结构, 能够以纤维素及其降解产物纤维二糖与纤维糊精为碳源, 发酵产生乙醇、乙酸、乳酸、二氧化碳和氢。1926年VILJOEN等[6]首次报道了热纤梭菌具有分解纤维素产乙醇的能力, 其稳定的纯培养物于1948年由MCBEE[7]分离纯化得到。热纤梭菌能利用纤维素、纤维二糖、葡萄糖、甘露糖、果糖和甘露醇生长, 但不能发酵戊糖和淀粉。与葡萄糖相比较, 热纤梭菌在纤维二糖上生长更迅速, 当培养基中同时含有纤维二糖和葡萄糖时, 其优先利用纤维二糖[8]。
培养基中的纤维二糖通过与三磷酸腺苷(ATP)结合的转运蛋白转运进入热纤梭菌细胞内, 随即在纤维二糖磷酸化酶的作用下转化为葡萄糖-1-磷酸和葡萄糖, 进而形成葡萄糖-6-磷酸, 然后进入EMP(Embden-Meyerhof-Parnas)途径, 最终转化为丙酮酸。研究发现, 热纤梭菌中没有EMP途径普遍存在的丙酮酸激酶, 磷酸烯醇式丙酮酸是由磷酸烯醇式丙酮酸羧激酶催化生成草酰乙酸, 接着被苹果酸脱氢酶还原成苹果酸, 最后由苹果酸酶催化生成丙酮酸[9, 10, 11]。生成的丙酮酸通过以下三种路径进一步转化:①被乳酸脱氢酶催化生成乳酸; ②在丙酮酸铁氧还蛋白氧化还原酶催化下生成乙酰辅酶A, 乙酰辅酶A经磷酸乙酰转移酶和乙酸激酶先后催化生成乙酸; ③乙酰辅酶A在乙醛脱氢酶和乙醇脱氢酶的作用下先生成乙醛, 再转化为乙醇(图1)。随着乙酸及乳酸的积累, 培养基的pH值逐渐下降, 细胞进入稳定期和衰亡期, 对纤维素的分解速率和产物的生成速率也随之降低。
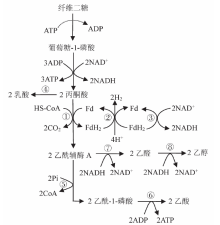 | 图1 ① 图1 纤维二糖在热纤梭菌中的代谢途径[12] 丙酮酸铁氧还蛋白氧化还原酶; ② 氢酶; ③ 铁氧还蛋白-烟酰胺氧化还原酶; ④ 乳酸脱氢酶; ⑤ 磷酸乙酰转移酶; ⑥ 乙酸激酶; ⑦ 乙醛脱氢酶; ⑧ 乙醇脱氢酶Fig. 1 The metabolic pathway of cellobiose in Clostridium thermocellum[12] |
与传统的酿酒酵母发酵相比, 热纤梭菌的乙醇产量较低, 且不能耐受高浓度的乙醇。据报道, 当外加乙醇浓度大于1%(w/v)时, 野生型热纤梭菌的生长受到明显的抑制[13, 14, 15]。WILLIAMS等[15]通过逐渐增加培养基中乙醇浓度的方法得到了一株能够耐受5%(w/v)乙醇的热纤梭菌, 在对这株菌及其野生菌株的蛋白质组学进行分析后, 发现与野生株相比, 很多涉及碳水化合物运输和代谢的膜结合蛋白的表达在乙醇耐受株中都明显降低, 尤其是纤维小体(cellulosome)的一些酶和结构组分表达下调; 这株菌仍然能降解纤维素, 但是降解速度及程度都比野生株低。
然而, 热纤梭菌的特性使其在乙醇发酵中具有以下优势[16]:①同时具备分解纤维素和产乙醇的能力, 使得糖化和发酵过程可以一步完成; ②厌氧菌发酵过程中不需要提供氧气。厌氧菌通常细胞产量低, 因此更多的底物可用于转化生成乙醇; ③属于嗜热菌, 最适生长温度达到60℃, 可以降低发酵罐的冷却成本, 而且高温发酵有利于乙醇的回收, 还可以降低染菌的几率。此外, 嗜热菌具有鲁棒性, 所含的酶蛋白比较稳定; ④可以和其他产乙醇或发酵戊糖的微生物一起培养。
热纤梭菌降解纤维素的机制与真菌不同, 真菌如里氏木霉(Trichoderma reesei)的纤维素酶为非复合型, 各纤维素酶组分独立存在, 由细胞分泌并游离于胞外, 而热纤梭菌是通过形成纤维小体这一多酶复合体来实现纤维素的高效降解:多种纤维素酶、半纤维素酶基于锚定-黏附机制组装成多酶复合体, 该复合体通过黏附蛋白固定于细胞表面。这一空间结构高度有序化的多酶复合体除了有催化协同作用外, 还会促发酶-酶邻近协同效应及酶-底物-细胞复合协同效应, 因此在纤维素降解能力上优于非复合型的纤维素酶。
1983年, LAMED等[17]首先在热纤梭菌中发现纤维小体, 其分子大小为2 × 106 ~ 6 × 106Da, 由大小为37 ~ 210 kDa不等的14 ~ 50个亚基组成。目前已知的产纤维小体的微生物主要包括热纤梭菌、解纤维梭菌(Clostridium cellulyticum)、食纤维梭菌(Clostridium cellulovorans)、约休梭菌(Clostridium josui)等[18, 19, 20]。纤维小体主要由两部分组成:一部分是含有锚定域(dockerin domain)的多酶亚基, 另一部分是含有一个或多个黏附域(cohesin domain)的脚手架蛋白(scaffoldin)[21]。纤维素酶通过锚定域与脚手架蛋白上的黏附域特异性结合, 组装成多酶复合体。脚手架蛋白上还含有一个纤维素结合域(cellulose-binding domain, CBD), 其作用是结合底物纤维素。不同微生物中纤维小体的结构组分和组装模式是不同的, 导致它们在纤维素降解能力上存在差异。
脚手架蛋白也称为纤维小体整合蛋白(cellulosome integrating protein, CipA), 既有结合纤维素的功能, 也具有细胞锚定功能。热纤梭菌的脚手架蛋白包含一个单独的CBD和9个非常相似的黏附域, 还有一个额外的结构域帮助纤维小体附着在细胞表面。CBD和黏附域具有相似的折叠类型, 但它们的功能组件明显不同。热纤梭菌纤维小体的结构及其与纤维素和细胞表面的相互作用如图2所示。其中I型锚定-黏附作用指的是脚手架蛋白上的黏附域和酶亚基上的锚定域之间的相互作用, 而II型锚定-黏附作用为脚手架蛋白的羧基末端锚定域与细胞表面锚定蛋白的黏附域之间的相互作用。
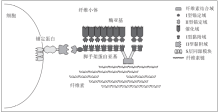 | 图2 热纤梭菌的纤维小体结构及其与底物、细胞表面的结合[22]Fig. 2 Structure of Clostridium thermocellum cellulosome and its binding to substrate and cell surface[22] |
纤维小体的催化域根据其序列相似性和折叠情况可以归到不同的糖苷水解酶(GH)家族。热纤梭菌纤维小体的酶组分主要包括内切葡聚糖酶(endoglucanase), 外切葡聚糖酶(exoglucanase)、木聚糖酶(xylanase)等, 此外还含有1个几丁质酶(chitinase)和1个地衣酶(lichenase), 其中纤维素酶类主要来源于GH5、GH9及GH48家族, 而木聚糖酶主要由GH10、GH11家族组成。表1为热纤梭菌纤维小体中的亚基组成。除催化域和锚定域外, 某些酶组分还包括其他的结构域, 如CBD和Ig(免疫球蛋白类似结构域)等。
大多数降解纤维素的细菌只有一个来自糖苷水解酶家族48(GH48)的纤维素酶, 而热纤梭菌含有两个:Cel48S(即CelS)和Cel48Y。Cel48S是纤维小体的重要组分, 属于外切葡聚糖酶; Cel48Y则是一个游离的纤维素酶。纤维二糖会抑制Cel48S的活性, 但Ca2+和巯基乙醇能提高其稳定性。OLSON等[23]敲除热纤梭菌的Cel48S基因后发现, 突变株的细胞产量及纤维素水解速率均下降, 而且其纤维小体对微晶纤维素的比活降低了35%, 而Cel48S和Cel48Y双敲除突变株对纤维素的降解性能却与Cel48S单敲除突变株基本相同。
研究表明, 生长条件显著地影响热纤梭菌的纤维素降解活性。热纤梭菌产纤维素酶的水平与生长所用的碳源有关, 在含果糖的培养基中, 细胞产生的纤维素酶效价比生长于纤维二糖时高7倍, 比生长于葡萄糖时高4倍[24]。此外, 纤维小体的组分也受到碳源的影响, 在结晶纤维素和经预处理的柳枝稷存在时, GH9的酶水平上升, 而只要有纤维素(普通、无定形或结晶)存在时, GH5的酶都显示水平增加[25]。里氏木霉水解纤维素的产物是纤维二糖, 热纤梭菌的产物则为较高分子量的纤维糊精(平均聚合度约为4), 这是由于热纤梭菌纤维小体上的催化酶大部分是内切葡聚糖酶[26]。热纤梭菌中纤维糊精磷酸化酶的活性较高, 可以快速吸收由内切葡聚糖酶随机水解产生的纤维糊精。
纤维小体在降解纤维素底物方面具有优势, 这不仅是因为其脚手架蛋白聚集的多酶, 还因为其构象灵活多变。GARCÍ A-ALVAREZ等[27]用冷冻电子显微镜研究热纤梭菌纤维小体的结构, 发现三个相邻的催化域以相反的方向交替地从脚手架蛋白向外突出, 该结构可以扩大底物对催化域的可及范围。黏附域之间的柔性连接使得纤维小体在降解非溶解性底物时能够延伸变换构型, 从而增强与底物的接触, 提高降解效率。
热纤梭菌因具有分解纤维素并将其转化为乙醇的能力而受到关注, 但是能够直接转化纤维素的微生物通常表现出低的乙醇产率, 热纤梭菌也不例外。据报道, 野生型热纤梭菌产生的最高乙醇浓度小于30 g/L[28]。目前, 热纤梭菌利用纤维素原料产乙醇仍存在以下几个问题:①还原性糖的积累及副产物乙酸、乳酸、氢等的形成会抑制乙醇的生成; ②虽然热纤梭菌能够分解木聚糖, 但缺乏木糖异构酶和木酮糖激酶, 因此无法代谢木糖或低聚木糖[16]; ③产物乙醇和有机酸对细胞具有毒性。
针对上述问题, 可以采取以下措施:采用热纤梭菌与其他能利用木糖的厌氧菌共培养的方式来提高乙醇产量; 选育耐乙醇的热纤梭菌菌株, 通过优化培养条件来提高乙醇得率; 对热纤梭菌进行基因工程改造, 抑制副产物的生成或强化乙醇合成途径, 或者将代谢木糖的基因导入热纤梭菌以提高其底物利用率及乙醇产率。
嗜热硫化氢梭菌(Clostridium thermohydro- sulfuricum)能发酵纤维二糖、葡萄糖和木糖, 但不能发酵纤维素。NG等[29]研究了热纤梭菌菌株LQRI和嗜热硫化氢梭菌菌株39E在某些纤维素底物上的共培养, 例如MN300纤维素、Avicel、Solka Floc、SO2处理过的木材以及蒸汽爆破法处理的木材等, 最高乙醇得率为0.46 g/g MN300纤维素。Thermoanaerobacterium saccharolyticum是一株能够直接发酵半纤维素和木聚糖的嗜热厌氧菌, 还能发酵纤维素生物质中的纤维二糖、葡萄糖、木糖、甘露糖、半乳糖和阿拉伯糖等[30]。ARGYROS等[31]将热纤梭菌和T. saccharolyticum共培养进行纤维素发酵, 在146 h内从92 g/L Avicel产生了38 g/L的乙醇, 而且由于这两株菌都是阻断了乳酸和乙酸合成途径的工程菌, 因而在发酵产物中未检测到乙酸和乳酸。
野生型热纤梭菌通常可以耐受低于16 g/L的乙醇[13], 但经过适应或工程改造的菌株可以在40 g/L的乙醇中稳定生长[15, 32], 而适应后的菌株甚至可在高达80 g/L的乙醇中存活, 尽管其生长非常有限[15]。对热纤梭菌野生型ATCC 27405菌株和衍生的乙醇适应型(EA)菌株重测序以鉴定与表型相关的突变[32], 结果发现EA菌株具有突变的adhE基因, 该基因编码双功能的醇/醛脱氢酶。将此adhE突变转移至热纤梭菌DSM 1313, 遗传分析表明该突变赋予了菌株耐受乙醇的表型。但是, 尽管菌株对乙醇的耐受性更高, 其在乙醇产率上并没有优势, 这说明还存在其他的代谢瓶颈。
OGUNTIMEIN等[33]开发了一种利用96孔板进行高通量(high throughput)筛选的方法, 通过比较两株热纤梭菌(Δ hpt和LL1210)分别以两种纤维素原料(Avicel和柳枝稷)为底物产乙醇的情况, 证明该方法可行, 可用于纤维素乙醇生产中的大规模筛选研究。LI等[34]研究了热纤梭菌发酵乙醇过程中氢酶抑制剂(H2、CO和甲基紫精)对产物选择性的影响。结果显示, 在一个底物(纤维二糖)有限的恒化器里, 将通入的气体由N2切换为H2时, 乙酸减少, 乙醇产量增加350%。热纤梭菌通过产H2、乳酸或乙醇将NADH氧化为NAD+, 当氢酶被抑制时, 后面两种产物增加。如果可利用底物过多会导致1, 6-二磷酸果糖增加, 从而触发乳酸的生产。而甲基紫精可以降低底物的转运速率, 对乙醇生产有促进作用。此外, 培养基的组成也是一个重要影响因素。BALUSU等[35]对热纤梭菌SS19的培养基进行了优化, 优化后的培养基含滤纸、玉米浆、半胱氨酸盐酸和硫酸亚铁分别为45 g/L、8.0 g/L、0.25 g/L和0.01 g/L, 利用该培养基发酵生产乙醇, 其乙醇得率达到0.41。
在基因工程改造方面, KANNUCHAMY等[36]将来自运动发酵单胞菌(Zymomonas mobilis)的丙酮酸脱羧酶(pdc)和醇脱氢酶(adh)基因克隆至pNW33N, 然后电转化热纤梭菌DSM1313, 获得重组菌株CTH-pdc、CTH-adh和CTH-pdc-adh。尽管异源的pdc和adh基因均在热纤梭菌中起作用, 但是adh的存在严重抑制了重组菌株的生长。与野生型菌株相比, 重组菌株CTH-pdc的丙酮酸脱羧酶活性和乙醇产量提高了两倍。
H2是热纤梭菌产乙醇过程的一个副产物, 抑制产氢可以使得更多的电子用于将乙酰辅酶A还原为乙醇。BISWAS等[37]敲除了涉及三个 [FeFe] 氢酶成熟(从脱辅基酶转变成全酶)的酶基因hydG, 进一步敲除 [NiFe] 氢酶基因(ech)后获得了功能上缺失全部氢酶的突变株。在突变株Δ hydGΔ ech中检测不到产氢, 且乙醇产量几乎翻了一倍, 达到最大理论产量的64%。对突变株Δ hydG的基因组进行分析后显示adhE基因发生突变, 导致菌株获得可依赖NADH或NADPH的醇脱氢酶活性。
XIONG等[38]将来自嗜热厌氧菌Thermoanaero- bacter ethanolicus的xylA(编码木糖异构酶)和xylB(编码木酮糖激酶)基因导入热纤梭菌DSM 1313, 使其不仅在纤维素上还可以在木糖上生长。将xylAB定向整合到热纤梭菌基因组中, 可实现葡萄糖、纤维二糖或纤维素与木糖的同时发酵, 而且没有碳分解代谢物阻遏。结果还显示同时利用木糖和纤维素时, H2和乙醇的产量是单独利用纤维素时的两倍。此外, 工程菌还可以在木糖存在时利用木糖低聚物(聚合度为2 ~ 7)。
热纤梭菌因其在整合生物加工技术上的优势而备受关注。近年来由于分子生物学技术的发展, 用于梭菌的新的遗传工具陆续被开发出来, 比如基于II型内含子的定向诱变系统targetron、选择性标记和反向选择性标记的发展、基于反转座子的基因阻断技术等, 这些工具的改进使得热纤梭菌的代谢工程得到快速发展。此外, 蛋白质组学、转录组学等各种组学技术的发展也为进一步阐明热纤梭菌的代谢调控机制提供了帮助。
但是, 尽管已经取得了长足的进步, 热纤梭菌用于纤维素乙醇的生产仍然处于实验研究阶段, 距离工业化生产还有一定的差距, 其中主要的问题包括以下几个方面:①纤维素发酵速度慢, 细胞产量低, 从而导致酶效低, 乙醇产量不高; ②受木质纤维素-水混合物机械性能的限制, 难以制备超过5%或6%(w/v)的乙醇, 固含量高于20%(w/v)时物料的混合将是个大的挑战; ③菌株的工业粗放性有待加强, 需要提高其对原料预处理时产生的抑制物的耐受性能。因此, 开发在工业条件下具有鲁棒性的菌株以及提升高底物负载下的底物转化率是未来工作的重要方向。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|


