作者简介:黎华玲(1987-),女,硕士,工程师,主要从事锂离子电池材料研究。陈永珍(1985-),女,硕士,工程师,主要从事锂离子电池研究。
随着电动汽车和大规模储能市场的快速发展,锂离子电池的销量快速增长,随之产生的废旧锂离子电池数量也日益增长。其中,三元正极锂离子电池含有锂、镍、钴、锰等有价金属,具有较高的回收价值。本文以废旧三元锂离子电池正极片为原料,采用高温热处理法去除正极中的黏结剂和导电碳,以提高有价金属在酸液浸出的回收率。重点考察了高温热处理的温度和时间对有价金属酸浸出率的影响。结果表明:当三元正极热处理温度为650℃、时间为120 min时,正极中黏结剂和导电碳分解完全;在酸浸实验中,在硫酸浓度为4 mol/L,H2O2体积含量为11.1%、固液比为55.5g/L、反应温度为80℃、反应时间为2 h条件下,锂、镍、钴、锰的浸出率分别达到99.5%、98.9%、98.7%、98.7%。
In recent years, with the rapid development of electric vehicles and large-scale energy storage market, the sales of lithium-ion batteries are also growing rapidly, and the number of spent lithium-ion batteries is also growing. Among them, the ternary cathode of lithium-ion battery contains valuable metals such as lithium, nickel, cobalt, manganese, which has high recovery value. In this paper, the binder and conductive carbon in spent ternary cathode were removed by high temperature heat treatment to improve the recovery of valuable metals in acid leaching. The effect of temperature and time of high temperature heat treatment on acid leaching rate of valuable metals was investigated. The experimental results showed that the binder and conductive carbon decomposed completely when the heat treatment temperature of the ternary cathode of lithium-ion battery was 650oC and the time was 120 min. Under the optimal leaching conditions of 4 mol/L H2SO4, 11.1vol.% H2O2, a solid-liquid ratio of 55.5g/L at 80oC for 2 hours, the leaching rate of lithium, nickel, cobalt and manganese were 99.5%, 98.9%, 98.7% and 98.7%, respectively.
锂离子电池由于能量密度高、寿命长、安全等优点, 在储能及汽车领域逐步普及[1, 2]。根据电车资源的信息统计, 2017年, 我国新能源汽车销售接近30万辆, 2018年和2019年销量也已突破百万大关。以上数据可见中国的新能源汽车产业发展迅速, 但是在新能源汽车大规模普及的背后, 一个严重又困难的问题迫切需要解决— — 报废电池处理。新能源汽车动力电池寿命一般为4 ~ 5年, 因此即将有大量动力电池进入报废期。从环境和资源角度来看, 大规模报废的动力电池具有很高的回收价值。其中, 三元锂离子电池有价金属含量较多, 对其有价金属(锂、镍、钴、锰)进行回收, 既可减少环境污染[3, 4, 5, 6, 7], 又可获取一定的经济效益[8, 9]。
目前, 三元锂离子电池正极有价金属的回收普遍采用酸浸出的方法[10, 11, 12]。但是正极片不仅含有活性材料, 还有导电碳、黏结剂和集流体(铝箔)等物质, 而导电碳和黏结剂在酸溶液中不溶解, 在浸出反应中容易形成一个灰层[13], 不利于有价金属在酸溶液中浸出。因此, 酸浸出实验前, 需要对材料进行预处理, 去除材料中的导电碳和黏结剂。常见的处理方法有溶剂法和高温法。利用相似相溶的原理, 溶剂法采用与黏结剂具有相同极性的有机溶剂来溶解黏结剂。N-甲基吡咯烷酮(NMP)溶剂能促进电极片黏结剂的溶解[14, 15]。YANG等[16]先将报废的电池充分放电后, 拆解得到电极片, 电极片裁成小方块, 放入NMP溶液中, 超声3 min, 黏结剂能有效地被溶解。但是溶剂法去除黏结剂不够彻底, 且导电碳没有溶解以及有新杂质NMP的引入, 因此仍有惰性物质残留在活性材料表面, 不利于有价金属浸出。高温法利用正极材料中每种物质分解温度的不同, 通过高温使物质分解失效, 得到纯净的活性物质。据文献报道, 黏结剂(PVDF)开始热分解温度大约在350 ~ 400℃[17], 导电碳开始分解温度约在600℃[18], 铝箔的熔点为660℃。SONG等[19]在对Li(Ni1/3Co1/3Mn1/3)O2电极材料进行热处理回收时, 把电极片剪成小片, 放入马弗炉中, 在350 ~ 450℃下反应2 h, 使得黏结剂热分解, 正极粉末从极片剥落, 从而收集得到正极粉末材料。但是, 此文献仅对黏结剂进行了分解处理, 忽略了导电碳对浸出实验的影响。
本文综合考虑电极片中各种物质的特性, 先采用碱溶法将电极片的集流体铝箔溶解, 得到含活性材料、导电碳以及黏结剂等的固体粉末, 然后采用高温热处理方法, 同时热分解黏结剂和导电碳, 考察高温热解的温度和时间对有价金属浸出率的影响。
取一废旧三元锂离子软包电池(LG公司生产, 20 A∙ h)放电至2.75 V, 拆解, 得到三元正极片。将正极片剪成3 cm × 6 cm大小, 浸泡于1 mol/L的NaOH溶液中, 持续搅拌10 min, 过滤, 得到黑色片状的正极材料(不含铝箔)。正极材料使用去离子水清洗干净后, 烘干、研磨成粉末状材料。
1.2.1 高温热处理实验
取适量的正极材料粉末置于管式炉中, 在空气气氛下进行加热保温, 由室温以10℃/min升温至650℃, 保温2 h, 得到黑色的正极粉末材料。
1.2.2 酸浸出实验
称取2.0 g经过高温热处理后的材料于三口烧瓶中, 加入配制好的40 mL 4 mol/L H2SO4溶液, 5 mL 30%过氧化氢溶液, 水浴加热回流并保持温度在80℃, 持续搅拌120 min, 得到正极材料有价金属浸出溶液。
1.2.3 回收三元材料中元素含量确定
量取浓硝酸和浓盐酸, 按照体积比为1:3配制成40 mL王水溶液。称取2.0 g高温处理后的正极材料于三口烧瓶中, 加入配制好的王水溶液40 mL, 在60℃恒温水浴持续搅拌5 h, 使材料完全溶解。将得到的溶液过滤, 稀释, 定容, 待测Li、Ni、Co、Mn、Cu、Al元素含量。
1.3.1 热重(TG)分析
采用德国林赛斯TA SDT650高温高压同步热分析仪进行热失重分析, 测试温度为40 ~ 900℃, 升温速率为5℃/min, 气氛为空气, 空气流速为 50 mL/min。
1.3.2 形貌分析
采用日立公司S-4800 FESEM场发射扫描电子显微镜(SEM)表征样品的形貌, 测试电压为25 kV。
1.3.3 电感耦合等离子体发射光谱仪(ICP)分析
试样中的有价金属元素采用美国OPTIMA 8000型电感耦合等离子体发射光谱仪(ICP)测试。
浸出率(leaching rate, L)计算公式:
${{L}_{\text{M}}}=\frac{{{M}_{\text{M}}}{{C}_{\text{M}}}V}{m{{w}_{\text{M}}}\text{ }\!\!%\!\!\text{ }}\times 100\text{ }\!\!%\!\!\text{ }$ (1)
式中:MM为金属M(M = Li, Ni, Co, Mn, Al)的相对分子质量; CM为浸出液中金属M离子的浓度; V为浸出液体积; m为正极原材料的质量; wM为正极材料中金属M的质量分数。
废旧的三元锂离子电池正极粉末金属元素的含量见表1。由表1数据可知, 正极材料的组成不是常规的三元材料, 掺杂的锰元素较多。
| 表1 废旧三元锂离子电池正极粉末金属的含量(质量百分数) Table 1 Metal content of ternary lithium-ion battery cathode powders (mass percentage) |
2.2 热重结果分析
图1是导电碳、黏结剂、正极材料在0 ~ 900℃、空气气氛下的热重-微商热重分析-差示扫描量热法(TG-DTG-DSC)曲线图。从图1a中TG曲线可以看出, 620℃开始, 导电碳的质量急剧下降, 804℃失重率达到最大值, 质量下降了97.35%。当温度继续升至900℃时, 导电碳基本分解完毕。在DSC和DTG曲线中, 在705℃、779℃时出现强放热峰, 在711℃时出现强质量变化峰, 对应的是导电碳的氧化反应:
$\text{C}+{{\text{O}}_{2}}=\text{C}{{\text{O}}_{2}}+Q$ (2)
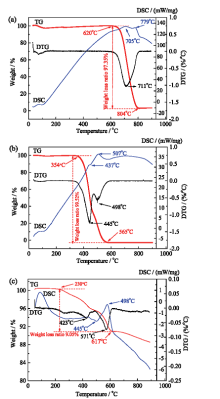 | 图1 导电碳(a)、黏结剂(b)和正极材料(c)的热重表征Fig. 1 Thermogravimetric characterization of conductive carbon (a), binders (b) and ternary lithium-ion battery cathode materials (c) |
如图1b所示, 黏结剂从354℃开始分解, 至565℃时基本分解完全, 在此过程黏结剂失重率接近100%。在黏结剂的DSC曲线中, 437℃开始出现一个明显的吸热峰, 507℃出现一个强放热峰, 其先后对应的是黏结剂(PVDF)的分解反应和碳氧化反应。
图1c为经过碱处理后的正极材料的TG-DTG- DSC曲线图。可以看出, 从230℃开始, 样品质量缓慢下降, 至500℃时质量下降了4.63%, 500℃开始分解加剧, 至600℃时质量下降了8.76%, 至617℃失重率达到最大值, 质量下降总量为9.05%, 质量下降主要原因是材料表面吸附的水分挥发、黏结剂的分解以及碳氧化挥发造成。在445℃和498℃时先后出现了强吸热峰和放热峰, 对应的是黏结剂分解反应和碳的氧化反应。当温度升至900℃时, 样品仍在缓慢分解, 但DSC谱图中没有观察到明显的吸热峰和放热峰。
通过图1三种材料的热分解温度可知, 导电碳热分解温度最高, 其次是黏结剂, 而正极材料最低, 这可能与正极材料中黏结剂和导电碳的含量及其存在形式有关。基于以上热重分析结果, 选择500 ~ 700℃温度区间作为正极材料热处理温度考察范围。
图2为三元正极材料经过不同温度处理后的SEM图。从图2a中可以观察到, 未经高温处理的材料, 由于黏结剂的存在, 材料团聚严重, 且颗粒不均匀, 分散性差。500℃高温处理如图2b所示, 由于黏结剂逐渐分解, 材料开始分散, 但表面仍附着小颗粒导电碳等杂质。随着温度的继续升高, 黏结剂和导电碳逐步热分解, 图中活性材料的颗粒表面附着的杂质减少, 颗粒与颗粒间的边界轮廓逐渐清晰。当温度为650℃时, 材料分散性良好, 颗粒大小均匀, 表面光滑且无杂质。当温度继续升至700℃时材料形貌变化不大(如图2f所示), 说明材料中的黏结剂和导电碳已基本分解完全。
图3为三元正极材料在650℃下不同保温时长的SEM图。从图中可以看出, 当保温时间为60 min时, 颗粒团聚严重, 大颗粒表面分布有许多小颗粒, 可能是残留的黏结剂和导电碳。随着保温时间延长, 黏结剂和导电碳逐渐分解。当保温时间为120 min时, 颗粒分散性良好, 表面光滑无残留物。进一步延长保温时间至150 min和180 min时, 颗粒分布更均匀。
2.4 酸浸出实验结果分析
回收三元正极材料时, 首先在空气气氛条件下分别经过500℃、550℃、600℃、650℃、700℃高温反应2 h, 然后自热冷却至室温, 再在硫酸溶液中进行浸出反应。经不同温度处理及未经高温处理的有价金属浸出率如图4所示。从图中可以看出, 未进行热处理的正极材料直接进行硫酸浸出, 其Li、Ni、Co、Mn浸出率分别为69.1%、68.3%、60.8%、69.4%; 当热处理温度为500℃时, Li、Ni、Co、Mn浸出率分别为85.2%、82.3%、71.1%、84.3%, 有价金属的浸出率明显上升; 当热处理温度为650℃时, Li、Ni、Co、Mn浸出率分别为99.5%、98.9%、98.7%、98.7%; 继续升高温度至700℃时, 各有价金属的浸出率曲线趋于平稳。由于浸出过程是一个固/液非均相反应, 化学反应均发生在材料颗粒的外表面[20], 而残留的黏结剂和导电碳在硫酸溶液中几乎不溶解, 在浸出的材料颗粒表面形成疏松多孔的灰层, 阻碍了酸溶液在颗粒表面的扩散。因此, 结合图2的SEM表征分析, 随着热解温度升高, 黏结剂和导电碳逐渐热解, 材料颗粒表面充分与酸液接触, 有价金属浸出率逐渐提高。当材料温度升高至650℃, 热解2 h后, 黏结剂和导电碳热解完全, 浸出率达到最大。
 | 图4 不同温度热处理的回收材料酸浸出结果图Fig. 4 Results of acid leaching of recycled materials treated at different temperatures |
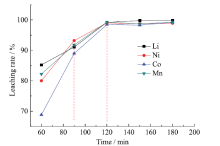
选取650℃对三元正极材料进行热处理, 分别保温60 min、90 min、120 min、150 min、180 min后, 再在硫酸溶液中浸出。如图5所示, 当保温时间为60 min时, Li、Ni、Co、Mn的浸出率分别为85.2%、79.8%、68.8%、82.2%; 至120 min时, Li、Ni、Co、Mn浸出率达到最大值, 分别达到99.5%、98.9%、98.7%、98.7%; 保温时间再延长至150 min和180 min时, 有价金属浸出率几乎不变。整体来说, 650℃热处理时, 随着保温时间的延长, 有价金属浸出率逐渐提高。结合图3的SEM表征结果, 随着保温时间的延长, 材料颗粒表面的黏结剂和导电碳含量逐渐减少, 酸溶液在材料颗粒的表面充分扩散, 有价金属容易被浸出。当保温时间大于120 min时, 残留在材料颗粒表面的黏结剂和导电碳已很少, 因此有价金属浸出率几乎不变。
考察了高温热解温度和时间对三元锂离子电池正极有价金属硫酸浸出反应影响, 结合热重和SEM表征结果以及浸出率曲线分析, 发现高温热解温度为650℃、时间为120 min时, 黏结剂和导电碳基本被热解, 在一定的酸浸出条件范围内, 三元正极材料有价金属Li、Ni、Co、Mn浸出率分别为99.5%、98.9%、98.7%、98.7%。通过简单的高温热解预处理, 可同时去除三元正极材料中黏结剂和导电碳杂质, 提高了有价金属在酸溶液中的浸出率, 为大规模的工业废旧三元锂电池回收提供了一种低成本、低能耗的回收方法。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|