作者简介:王旭尧(1995-),男,硕士研究生,主要从事聚合物电解质方面的研究。张灵志(1969-),男,博士,研究员,博士生导师,中国科学院“百人计划”,主要从事有机光电材料和纳米材料的设计合成及其在电化学储能器件的应用研究。
聚合物电解质能够避免传统液态电解液漏液的隐患,抑制锂枝晶的生长,提高电池的安全性能。单离子导体是一类锂离子迁移数接近1的聚合物电解质,能有效避免阴离子移动产生浓差极化,降低内部阻抗,从而提高锂电池的容量以及循环性能,成为近年来聚合物电解质的研究热点。本文综述了单离子导体聚合物电解质的研究进展,尤其关注离子电导率和锂离子迁移数较高的体系,并探讨了单离子导体聚合物电解质所面临的挑战以及发展前景。
As key components of lithium batteries, the electrolytes greatly impact on the electrochemical performances such as capacity, cycle stability, safety and operating condition of the cells. Comparing with the traditional liquid electrolytes, polymer electrolytes have advantages of high safety, good thermal stability, and wide electrochemical window. Single lithium-ion conducting polymer electrolytes (SLIC-PEs), which have anions covalently bonded to the polymer backbone or immobilized by anion acceptors, can avoid concentration polarization caused by anionic movement and suppress the growth of lithium dendrite. Recent developments in single-ion conducting electrolyte materials for lithium batteries were reviewed in this article, with primarily focus on those polymers with high ionic conductivity and high lithium-ion transference number. The current challenges and future perspectives in this field were also prospected.
锂离子电池因其工作电压高、能量密度大、无记忆效应、循环寿命长等优点, 在手机、笔记本电脑等便携式电子设备中广泛应用。锂离子电池主要由正负极材料、隔膜、电解液组成。现有商用的锂电池多采用含有碳酸脂类有机溶剂的液态电解质, 存在易漏液、易燃等安全隐患, 阻碍了其进一步的应用[1]。与有机电解液相比, 使用聚合物电解质可以避免传统锂电池的漏液问题, 提高电池的安全性能, 并且与电极相容性较好, 以及抑制锂枝晶的生长, 同时由于其良好的力学加工性能使得薄膜化、微型化、柔性可弯折的锂电池成为可能[2, 3]。
聚合物电解质, 即以高分子聚合物作为主体进行离子传输的电解质材料, 在锂离子电池中, 既作为隔膜起到隔绝正负极直接接触防止短路的作用, 又作为电解质传输离子和传导电流。自1973年WRIGHT等[4]发现聚氧化乙烯与碱金属盐的络合体系具有离子导电性起, 聚合物电解质得到广泛关注。但大多数聚合物电解质和商用电解液一样为双离子导体, 所以锂离子迁移数不高(${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$< 0.5), 在充放电中阴离子的迁移对导电过程并无贡献, 还会聚集于正极表面形成浓度差, 从而影响电池循环性能[5, 6, 7]。针对这个问题, 研究人员通过将阴离子以化学键连接到聚合物骨架或者引入阴离子受体限制阴离子移动, 提高锂离子迁移数, 这一类聚合物电解质被称为单离子导体[8]。单离子导体聚合物电解质的锂离子迁移数${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$接近1, 可以有效抑制阴离子产生浓度梯度, 从而能在锂金属表面上稳定地进行镀锂/剥离, 并最大限度地利用电极材料。本文将综述近年来单离子导体聚合物电解质的研究进展, 重点关注离子电导率较高和锂离子迁移数较高的体系。
聚合物电解质作为电池的关键组分, 在结构设计合成时其性质和关键参数的表征应当满足一定要求才能保证电池的正常工作[9, 10, 11]。
1.1.1 离子电导率
离子电导率可用式(1)表示:
$\sigma \left( T \right) = \sum {{n_{\rm{i}}}{q_{\rm{i}}}{\mu _{\rm{i}}}} $ (1)
其中:σ (T) 是温度为T时的离子电导率; ${n_{\rm{i}}}$为载流子数; ${q_{\rm{i}}}$为载流子所带电荷数; ${\mu _{\rm{i}}}$为载流子迁移速度。离子电导率是衡量离子传导性的标准, 决定电池电化学性能的关键参数之一, 电导率的高低会影响聚合物锂电池的充放电和倍率等性能。要保证电池正常充放电, 凝胶电解质需接近液态电解质的1 × 10-3 ~ 1 × 10-2 S/cm, 固态电解质大于1 × 10-4 S/cm。
1.1.2 锂离子迁移数
将Li+的迁移数量占电解液中所有的离子迁移数量的比例为锂离子迁移数[12]。
${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}} = \frac{{{D_ + }}}{{{D_ + } + {D_ - }}}$ (2)
其中:D+是Li+扩散系数, D-是阴离子扩散系数。Li+的迁移数可以简单地视为Li+提供电导率的分数[13]。电解质的电导率是由阴阳离子加合而成, 阴离子不参与电极的反应, 所以只有Li+的迁移对锂离子电池才有意义, 从上式可知, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$越接近1, 电解液中迁移的Li+占比就越高, 那么电解液在正负极之间传递电荷效率就会越高。所以, 锂离子迁移数会影响电池的循环效率和容量。
1.1.3 机械性能
聚合物电解质在组装中还充当隔膜的作用, 需要自身具有良好的机械强度, 能承受一定的压力, 防止破裂导致电池正负极直接接触而发生短路, 同时缓冲在充放电过程中电极的体积膨胀。而且由于聚合物电解质能够薄膜化, 在将其应用于锂电池时, 可以设计出多种形状的锂电池。
1.1.4 电化学稳定窗口
电化学稳定窗口是指电解质能够稳定存在的电压极限。锂离子电池电压高达3 ~ 4 V, 保证电池正常充放电要求体系电压在0 ~ 4.5 V(vs. Li+/Li)稳定而不分解。
1.1.5 热稳定性
热稳定性是指电解质的耐热性, 指其在温度的影响下的形变能力, 形变越小, 稳定性越高。首先在电池工作温度范围内(-20 ~ 60℃)必须保持稳定, 其次当电池发生热失控时热收缩小, 防止热缩导致正负极直接接触发生短路等安全问题。
按照相态可将聚合物电解质分为固态电解质和凝胶电解质, 其区别在于成分上除了聚合物基体和锂盐外, 凝胶电解质还含有增塑剂呈凝胶态。常见的溶剂有碳酸丙烯酯(propylene carbonate, PC)、碳酸乙烯酯(ethylene carbonate, EC)、碳酸二甲酯(dimethyl carbonate, DMC)、碳酸二乙酯(diethyl carbonate, DEC)、碳酸甲乙酯(ethyl methyl carbonate, EMC)等等。
常见的聚合物电解质中, 按照聚合物基体可分为聚氧化乙烯基(polyethylene oxide, PEO)、聚丙烯腈基(polyacrylonitrile, PAN)、聚甲基丙烯酸甲酯基(polymethyl methacrylate, PMMA)、聚偏氟乙烯基(polyvinylidene fluoride, PVDF)和聚偏氟乙烯-六氟丙烯基(polyvinylidene fluoride-hexafluoropropylene, PVDF-HFP)等。其结构式及相关性质见表1。
| 表1 常见聚合物基体及其基本性质 Table 1 Common polymer matrix and their basic properties |
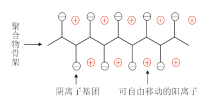
按照离子传输机制可将聚合物电解质分为双离子传输型和单离子传输型[14, 15]。双离子型聚合物电解质是指聚合物骨架只起支撑作用, 小分子锂盐在电场作用下分离成阴离子和阳离子, 阴离子与聚合物骨架相互作用力很小, 在充放电过程中两种离子向相反方向移动, 所以锂离子迁移数小于0.5。单离子型聚合物电解质是指阴离子与聚合物骨架以共价键相连接或引入阴离子受体, 从而限制阴离子的移动, 只有阳离子可以自由移动的聚合物电解质, 结构如图1。在锂离子电池充放电过程中, 只有锂离子在迁移, 理论上阴离子迁移数接近0, 锂离子迁移数接近1[16, 17]。
单离子导体聚合物电解质通过固定阴离子可以抑制阴离子浓差极化, 从而降低内部阻抗并提高放电电压, 同时单位电流所产生的焦耳热少, 降低了电池热失控的风险[18]。
DOYLE等[19]发现当电解质的锂离子迁移数${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$= 1时, 材料利用率, 功率和能量密度比${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$≈ 0.2时都有了显著提高。此外, 根据CHAZALVIEL[20]提出的模型, 锂离子迁移数接近1的电解质还能够有效抑制锂枝晶的生长。与双离子电解质相比, 均匀分布的锂离子, 可有效降低充电时不规则的锂沉积, 即使高电流密度条件下也可以在锂金属表面稳定电镀剥离[21]。因而, 设计合成阴离子不发生迁移使得${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$接近于1的单离子导体聚合物引起了人们广泛的兴趣。常见的单离子导体聚合物电解质按照与锂离子作用的阴离子基团的不同, 可分为羧酸型(-COO-), 磺酸型(-SO3-), 硼酸型(-BO4-), 磺酰亚胺型(-SO2N(-)SO2-)等。
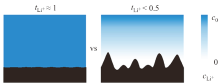 | 图2 锂离子迁移数对锂枝晶生长的影响[21]Fig. 2 The effect of lithium ion transference number on the growth of lithium dendrites[21] |
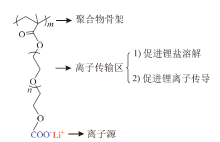
1989年, TSUCHIDA等[22]制备了一种含羧酸锂的均聚物P(EMEnM), 其结构单元由高分子链、离子传导区和锂离子源三个部分组成, 如图3所示, 高分子主链起结构支撑作用; 低聚PEO作为离子传导区传输Li+, 含有的路易斯碱氧原子可促进锂盐的溶解, 并提供柔性; -COOLi作为锂离子源提供Li+。60℃时, 该均聚物的电导率为1 × 10-8 S/cm。同一温度下当结构中的n由3提升至7时, 电导率增大了5倍, 表明适当增加柔性链段的长度, 可以降低Tg, 提高电导率。虽然其室温电导率较低, 远达不到应用要求, 但对聚合物电解质分功能区域设计的思想, 对之后聚合物电解质的设计具有重要指导意义。
ROLLAND等[23]合成了一种多功能嵌段电解质PS-b-P(MALi-co-OEGMA), 如图4a所示。9个单元的POEGMA为无定形结构, 提供了较高的室温电导率, 但其呈粘稠液体, 掺入刚性较强的聚苯乙烯(polystyrene, PS)提升力学性能, 基于聚合物主链阴离子的单离子构型可提供较高的锂离子迁移数, 优化了大分子的结构。二嵌段共聚物制备的聚合物电解质膜具有优异的机械性能, 同时室温离子电导率为2 × 10-5 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.84。
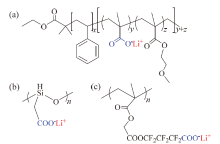 | 图4 羧酸型单离子导体聚合物电解质[22, 23, 24, 25]Fig. 4 Chemical structures of carboxylate-based SLIC-PEs[22, 23, 24, 25] |
HUANG等[24]合成了硅氧烷基为主链的单离子导体, 如图4b, 利用含-Si-O-单元的柔性主链提高离子电导率, 室温离子电导率为5 × 10-6 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$达0.91。
由于羧酸根的配位作用强, 锂离子不易解离, 通过引入强吸电子的基团, 增加羧酸阴离子负电荷的离域程度, 使得锂离子更容易从羧酸根上解离, 从而有效地提高离子电导率。BANNISTER等[25]将吸电子基团-CF2CF2-引入到聚甲基丙烯酸酯支链中, 制备了全氟烷基羧酸盐型(-CF2CF2COOLi)锂单离子传导固体聚合物电解质, 如图4c。其电导率比烷烃基的提升了两个数量级, 为2.5 × 10-6 S/cm。但过强的配位作用限制了基于羧酸根单离子导体的进一步研究。
磺酸根阴离子(-SO3-)的负电荷离域程度高于羧酸根, 使得Li+更容易解离, 因而磺酸锂替代羧酸锂在单离子导体聚合物电解质中被广泛研究。
20世纪90年代, 基于PEO的磺酸盐单离子导体得到广泛研究, 如图5a[26], 尽管其锂离子迁移数能达0.98, 但其室温离子电导率过低, 仅1 × 10-7 S/cm, 而且这些基于低聚PEO的电解质的机械性能过低, 难以形成自支撑膜, 妨碍了对其电化学性能的进一步研究。随后, 通过引入刚性基团或者改变聚合物主链的尝试有效的增加了机械强度。PARK等[27]通过引入苯环, 加强了电解质膜的力学性能(图5b), PEO与聚苯乙烯磺酸锂(PSSLi)共混制备的单离子导体最优比例时${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.85, 离子电导率为1 × 10-6 S/cm。DOYLE等[28]以线性聚乙烯亚胺作为聚合物骨架制备了带有N-丙基磺酸锂基团的线性聚乙烯亚胺(bPEI)的单离子导体, 如图5c, bPEI能够促进离子对的解离且成膜性较好, 室温离子电导率为4 × 10-4 S/cm。
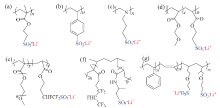 | 图5 磺酸型单离子导体聚合物电解质[26, 27, 28, 29, 30, 31, 32, 33]Fig. 5 Chemical structures of sulfonate-based SLIC-PEs[26, 27, 28, 29, 30, 31, 32, 33] |
在聚合物中引入环氧乙烷(EO)单体, 能够提高聚合物主链的链段运动, 促进锂离子的迁移, 可制备磺酸锂型(图5d)[29], 三氟丁烷磺酸锂型(图5e)[30]共聚电解质。DING等[31]通过将可锂化磺酸单体和含氟单体接枝到PVDF上合成共聚物g-PVDF-AMPSLi(图5f), 加入EC/DMC(1∶ 1)增塑剂后室温离子电导率为2.08 × 10-5 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.93。之后, 他们又设计合成了吸电子基团-CF2-更多的PVDF-HFP-g-AMPSLi[32], 其室温电导率提高至3.4 × 10-5 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$也提高到0.97。
LIU等[33]制备了一种新型的三嵌段共聚物, 如图5g, 由高Tg的PS链段增加机械强度, 低Tg的聚异戊二烯链段增加柔韧性, 离子源为带有磺酸锂侧基的聚异戊二烯段。具有功能化分区结构的聚合物电解质室温下离子电导率为1.45 × 10-4 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.92, 同时在抑制锂枝晶生长方面表现出色。
四面体硼酸盐基锂盐具有相当高的离子电导率, 良好的热稳定性, 制备简便, 成本低廉, 环境友好等的特性, 因此硼酸盐基也受到广泛关注。
ZHU等[34]用不同比例的聚丙烯酸、硼酸、氢氧化锂和草酸制备草酸锂聚丙烯酸硼酸锂(LiPAAOB, 图6a), 加入3%增塑剂PC后呈现出单离子导电行为, 其在环境温度下的离子电导率为2.3 × 10-6 S/cm, 并且电化学稳定窗口高达7.0 V。
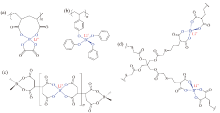 | 图6 硼酸型单离子导体聚合物电解质[34, 35, 36, 37]Fig. 6 Chemical structures of tetrahedral borate based SLIC-PEs[34, 35, 36, 37] |
将硼原子连接到共轭基团可通过π 键共轭增强硼原子的电子离域, 从而促进锂离子的离解并增加离子电导率。XU等[35]合成了聚(4-乙烯基苯酚)酚酸锂硼酸酯(LiPVPPB, 图6b), 并通过溶液流延法将LiPVPPB与PVDF-HFP混合。LiPVPPB中的酚环与硼原子键合, 通过π 键共轭促进电荷离域, 室温离子电导率为4.4 × 10-4 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.91。ZHANG等[36]合成的聚四甲酸丁烷硼酸锂(LiPBAB, 图6c), 同样与PVDF-HFP混合后, 所获得的多孔膜可吸收126%的EC/PC(1∶ 1), 从而在室温下的离子电导率为2.9 × 10-4 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.89。此外, 其在机械强度方面表现出色, 为33 MPa的拉伸强度。
DENG等[37]通过光引发的原位硫醇-烯Click反应, 将双(烯丙基丙二酸)硼酸锂(LiBAMB)和季戊四醇四(2-巯基乙酸)酯(PETMP)偶联合成的单离子导体(图6d)在溶剂丁内酯(Gamma- butyrolactone, GBL)中有着高于自重900%的吸液率。该聚合物电解质室温离子电导率高达1.47 × 10-3 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.89, 电化学稳定窗口为5.2 V。
硼酸盐中含大量B— O键, 其对水分十分敏感, 影响了其在电池性能中的稳定性, 从而限制了应用。
磺酰亚胺阴离子因为其负电荷的共轭结构高度离域化, 使得Li+易解离, 同时稳定性较好, 结构灵活, 得到广泛的研究。
在磺酰亚胺阴离子中, 双苯磺酰亚胺是最广泛研究的结构之一, 磺酰亚胺两端通过化学键与具有高度负电荷离域的苯环连接而增强了整个结构的电子离域程度。ROHAN等[38]通过Hinsberg反应合成了含双苯磺酰亚胺的单离子导体, 如图7a, 与PVDF混合组成的聚合物膜在EC:PC(1∶ 1)的溶剂下室温离子电导率为1.1 × 10-3 S/cm。该膜具有0.87的${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$和4.5 V的电化学稳定窗口, 拉伸强度达8.9 Mpa。
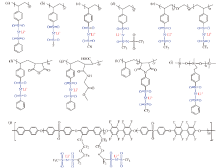 | 图7 磺酰亚胺型单离子导体聚合物电解质[21, 38, 39, 40, 41, 42, 43, 44, 45, 46]Fig. 7 Chemical structures of sulfonylimide-based SLIC-PEs[21, 38, 39, 40, 41, 42, 43, 44, 45, 46] |
除了苯环外, 常用于改性阴离子的基团还有-CF3、-F[39](图7b)、-CN[40](图7c)等, 引入强吸电子基团能够有效促进Li+的离解, 引入抗氧化稳定性强的氰基可拓宽电化学稳定窗口。MA等[41]设计了一种强大的吸电子基团 =NSO2CF3取代 =O形成更多电子离域的阴离子结构, 图7d。超离域的负电荷分布使Li+离子与阴离子高度解离, 还提高了离子传导所需的固态电解质中非晶相的程度和分段运动。
BOUCHET等[42]合成了一种BAB三嵌段结构的共聚物, 如图7e, 其中双(三氟甲烷)磺酰亚胺锂(lithium bistrifluoromethanesulfonimide, LiTFSI)共价键合到PS主链上。由于PS是离子绝缘体, 必须将Li+置于富含PEO的微相中才能有效地进行离子传输, 其离子电导率为3.4 × 10-5 S/cm。
CAO等[43]通过双苯磺酰亚胺锂单体与马来酸酐自由基共聚反应, 合成一种具有交替结构的单离子导体, 如图7f, 与PVDF-HFP在EC/PC(1∶ 1)的溶剂中混合。引入高介电常数酸酐可促进锂离子离解, 室温下离子电导率为2.67 × 10-3 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.98, 还具有5.3 V的宽电化学稳定性窗口和18.9 Mpa的高拉伸强度。之后, 他们又对电解质改进[44], 用甘氨酸乙酯与马来酸酐反应形成支链, 如图7 g, 该结构增强Li+的解离, 同时形成的支链可增加主链的链段运动, 促进Li+的迁移。与PEO混合溶液浇铸制备的固态电解质膜, 无增塑剂时, 室温下的离子电导率为1.42 × 10-4 S/cm, 0.93的${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$和6.0 V的宽电化学稳定性窗口, 在电池的长循环性能上表现优异。
DU等[21]将既含苯环又有-CF3改性的磺酰亚胺侧链接枝到聚(苯乙烯-马来酸酐)共聚物上制备单离子导体, 如图7h。由于丰富的非极性苯环和较低的离子交换容量(IEC), 锂化聚合物不溶于水, 可以在一个多月的电池长循环中保持稳定, 室温下离子电导率为1.6 × 10-4 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.93。
除了在阴离子基团改性外, 设计适合的聚合物骨架也能提高电解质性能。ROHAN等[45]将双苯磺酰亚胺接枝到具有高灵活性的聚硅氧烷上, 锂化后得到接枝聚合物(SG, 图7i)。聚硅氧烷是一种无定形聚合物, 具有非常低的Tg和热稳定性好, 因此SG的热稳定性高达410℃。SG与PVDF-HFP共混浇铸成膜, 加入增塑剂EC/PC(1∶ 1)室温下离子电导率达到0.72 × 10-3 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.89。NGUYEN等[46]通过相分离法制备了含有多芳香族结构聚合物骨架的多嵌段电解质膜, 如图7j, 包含了刚性强、高玻璃化转变温度和弱配位的嵌段。在30℃下EC增塑后离子电导率超过1 × 10-3 S/cm, 其${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$达到了1, 同时电化学稳定窗口接近5 V。
图8为其他阴离子结构的单离子导体聚合物电解质, 包括以铝和磷为中心原子的结构, 和以金属有机框架化合物(metal organic framework, MOF)或共价有机框架化合物(covalent organic framework, COF)材料为主体的新型结构。
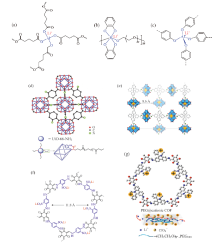 | 图8 其他阴离子结构的单离子导体聚合物电解质[47, 48, 49, 50, 51, 52, 53]Fig. 8 Chemical structures of SLIC-PEs based on other anions[47, 48, 49, 50, 51, 52, 53] |
XU等[47]通过溶液浇铸法将聚戊二酸铝锂与PVDF-HFP混合, 制得基于四烷氧基铝酸盐的电解质膜, 图8a, 随后将所得膜加入增塑剂EC/PC(1∶ 1), 锂离子与四烷氧基铝酸盐之间的弱缔合, 室温下的离子电导率为1.47 × 10-4 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.80。SUN等[48]通过逐步合成法由PCl5, 草酸和聚乙二醇合成含磷的单离子导体聚合物电解质, 如图8b, 其固态电解质在室温下离子电导率大于1 × 10-5 S/cm。
近年来, 将MOF和COF等微孔材料作为离子导电材料得到广泛研究, 由于其具有稳定的孔结构及稳定的化学结构, 使其可以在容纳有机溶剂的同时保持固态结构。将阴离子固定于MOFs和COFs的分子结构单元, 可制备单离子导体。FISCHER等[49]制备了第一个以Al为金属源的阴离子MOF, 如图8c, 实现了MOF自由Li+高负载值, 其离子电导率为5.7 × 10-5 S/cm。
WANG等[50]将MOF材料UiO66-NH2表面用C=C双键修饰后与PEGDA化学键合制备聚合物电解质, 如图8d。与PEGDA链以化学键连接的MOF纳米颗粒可以形成空间网格结构, 可以为Li+提供额外的传输通道, 并有效吸附系统中的杂质, 其30℃时离子电导率为4.31 × 10-5 S/cm。XU等[51]采用亚胺缩合法制备了三维结构的MOF-688, 如图8e, 该结构由对位氨基官能化的多金属氧酸盐连接4-甲酰基苯基甲烷四面体, 将其锂化后得到基于MOF-688的单离子导体, 20℃时离子电导率为3.4 × 10-4 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$= 0.87, 且与锂金属界面阻抗较小。
JEONG等[52]设计了一种具有定向离子通道、高密度锂离子的单离子导体, 如图8f, 无需增塑剂, 在室温下离子电导率为2.7 × 10-5 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.9。GUO等[53]将聚乙二醇(PEG)引入COF的有序通道中以促进Li+的传输, 如图8g, 同时保持了较好的柔韧性, 这种固态电解质在120℃下离子电导率为1.78 × 10-3 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.6。COF的有序受限空间, 不仅可以封装PEG/Li+, 而且可以调节其热行为, 促进Li+解离。
引入阴离子受体来限制阴离子的移动也是常用提高锂离子迁移数的方法之一。阴离子受体主要由路易斯酸组成, 通过路易斯酸碱相互作用与阴离子相互作用, 形成体积更大、电荷离域程度更高的新的阴离子。阴离子被固定, 增强锂离子的离解, 从而提高离子电导率和锂离子迁移数。DAI等[54]将线性含硼交联剂和支链含硼交联剂(图9a)以纤维素膜为支撑, 在液态电解质1 mol/L LiTFSI/EC/DMC中原位聚合得到交联的电解质3D-BGPE, 路易斯酸性硼酸酯充当阴离子受体, 通过吸附相互作用固定TFSI-阴离子, 从而提高了热稳定性和离子转移数。其室温下离子电导率为8.4 × 10-4 S/cm, ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$为0.76。
另一类代表性的阴离子受体是杯芳烃衍生物, 通过多个氢键作用与阴离子形成络合。如体积较小的杯[6]吡咯(C[6]P, 图9b), 在聚合物电解质PEO/LiBF6[55]和PEO/LiTF[56]体系中仅加入摩尔浓度为12.5%的C[6]P锂离子迁移数可提升至0.78和0.74。STEPHAN A M等[57]向电解质PEO/LiCF3SO3中加入杯[2]-p-苯[4]吡咯(图9c), ${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$从0.23提高至0.78, 同时也降低了界面阻抗。但杯芳烃由于过大的位阻效应, 若添加量过多势必会同时影响锂离子的迁移。
尽管阴离子受体不能完全抑制阴离子移动, 但添加适宜的阴离子受体是最简便有效提高锂离子迁移数的方法之一。阴离子受体的主要面临的问题是选择性差和自聚, 同时还需考虑阴离子受体与电极材料的相容性[58]。
随着锂离子电池应用范围的拓宽, 对聚合物电解质的力学性能、界面稳定性、安全性能等要求也越来越高。离子电导率和阳离子迁移数是衡量聚合物电解质性能优劣的重要参数。在电池的充放电循环中, 只有锂离子的电荷传输为有效电荷, 反映电池的充放电特性, 锂离子迁移数反映了充放电过程中传输有效电荷的占比, 当${t_{{\rm{L}}{{\rm{i}}^{\rm{ + }}}}}$大于0.7体现单离子导电特性时, 能显著提升锂离子电池的快充能力[12], 因此增加电解液的电导率的同时, 保持高的迁移系数对于提高锂离子电池的功率密度和能量密度具有重要的意义。
在聚合物电解质中, 阴离子通过共价键合到聚合物主链或与阴离子受体相互作用而被固定, 使得阳离子迁移数接近于1, 从而抑制阴离子浓度极化。同时通过设计并合成高负电荷离域的阴离子或引入强吸电子基团提高电子离域, 提高锂离子与阴离子的解离度以增加离子电导率。尽管分子结构的改进使得单离子导体聚合物电解质性能上有提升, 但距离实际应用还存在一定差距, 理想的聚合物电解质应满足更高的要求:①进一步提高离子电导率, 尽管凝胶电解质已经能达到商业化要求, 但更安全的固态电解质的室温离子电导率仍然较低; ②进一步提高Li+的解离程度, 从而提高室温电导率。从分子结构设计上采用弱配位阴离子或者引入吸电子基团等; ③提高聚合物电解质的机械强度, 合理设计嵌段聚合物电解质的功能化结构; ④用离子液体或者磷酸盐类等不可燃的增塑剂替换易燃的增塑剂, 增加安全性; ⑤优化聚合物电解质与电极材料尤其锂金属之间的相容性, 以增加电池的化学稳定性。
虽然单离子导体聚合物电解质的基础研究已经取得了长足的进步, 但对于其应用仍处于起步阶段。随着对单离子导体聚合物电解质的了解不断加深和全面, 其有望取代液体电解质应用于锂电池。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|