作者简介:吴康龙(1996-),男,硕士研究生,主要从事水合物海水淡化研究。谢应明(1976-),男,博士,副教授,主要从事气体水合物应用技术和新型制冷空调技术研究。
提出一种基于水冷压缩式制冷循环的CO2水合物海水淡化方法,并进行了CO2水合物海水淡化实验,实验选取4种不同的初始海水盐度(10‰、20‰、30‰、40‰),控制其温度为20℃,在4种不同的充注压力(3.6 MPa、3.8 MPa、4.0 MPa、4.2 MPa)下进行实验,考察了初始海水盐度和充注压力对海水淡化效果的影响。结果表明,充注压力越高,初始海水盐度越低,水合反应预冷时间越短。在充注压力为4.2 MPa、初始海水盐度为10‰时,预冷时间最短(15.01 min),淡化水产量最高(3 172.34 g),淡化速率最快(211.35 g/min),淡化水盐度最低(4.49‰),盐去除率为5.11‰。在充注压力为4.2 MPa、初始海水盐度为30‰时,淡化水产量为2 868.66 g,淡化速率为165.63 g/min,淡化水盐度为6.49‰,盐去除率最高,为8.37‰。充注压力越高,初始海水盐度越低,则淡化水能耗越低。
A hydrate seawater desalination method based on water-cooled refrigeration cycle was proposed and the hydrate seawater desalination experiment was carried out. Four different initial seawater salinities (10‰, 20‰, 30‰, 40‰) were chosen and were experimented at controlled temperature of 20°C and 4 different filling pressures (3.6 MPa, 3.8 MPa, 4.0 MPa, 4.2 MPa), the effects of the initial seawater salinity and charging pressure on the desalination effect were studied.Results showed that the higher the charging pressure, the lower the initial seawater salinity and the shorter the pre-cooling time of the hydration reaction. When the charging pressure was 4.2 MPa and the initial seawater salinity was 10‰, the pre-cooling time (15.01 min) was the shortest, the desalination water output was the highest (3 172.34 g), the desalination rate was the fastest (211.35 g/min), the desalination water salinity was the lowest (4.49‰), the salt removal rate was 55.11‰. When the charging pressure was 4.2 MPa and the initial seawater salinity was 30‰, the desalination water output was 2 868.66 g, the desalination rate was 165.63 g/min, the desalination water salinity was 6.49‰, and the salt removal rate was the highest (78.37‰). The higher the charging pressure and the lower the initial seawater salinity was, the lower the energy consumption of desalinated water was.
当前淡水资源匮乏问题日益严重, 而全球水资源总量中近97.5%的水为海水等咸水资源[1]。淡化资源短缺逐渐成为制约人类社会可持续发展的全球性问题[2]。海水淡化技术作为一种解决淡化资源紧缺的有效手段[3], 正在被人们进行广泛的研究。目前商业化的大型海水淡化技术主要有反渗透(reverse osmosis)、多级闪蒸(multistage flash)和低温多效蒸馏( low temperature multi-effect distillation)[3, 4, 5]。水合物法分离是一种新兴的分离技术, 包括海水淡化等[6]。故可以考虑水合物法作为未来海水淡化的储备技术之一[7]。可持续发展要求海水淡化系统具有优良的经济性[8], 系统可以连续制备水合物, 符合可持续发展要求。PARKER[9]首次提出水合物海水淡化技术。龙榛等[10]提出了一种新型水合物法海水淡化流程, 通过模拟计算, 详细分析了海水淡化的能耗。李峰[11]采用石墨进行了强化水合物法脱盐研究, 发现石墨颗粒对水合物的生成有促进作用。王永青[12]认为低温多效压汽蒸馏(low-temperature multi-effect thermal vapor compression, LT-METVC)海水淡化是一种很有发展前途的海水淡化方法。杨亚彬等[13]对CO2水合物法海水淡化装置的㶲及能耗进行了分析。本文采用一种基于直接接触式制冷循环的水合物法海水淡化装置, 将传统静态反应釜改造成动态反应系统, 通过改变初始充注压力和采用不同浓度的初始海水盐度进行海水淡化实验研究。
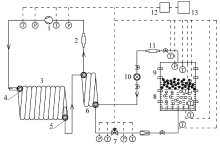
实验装置包括水合反应釜(外覆保温材料)、散流器、压缩机、套管式水冷换热器、恒温水浴槽、回热器和其他辅助设备如干燥过滤器等。数据采集系统包括温度传感器、压力传感器、气体质量流量计。温度、压力数据采集由安捷伦(Agilent)系统完成, 实验装置示意图如图1所示。
实验中, 系统所充注的CO2采购自上海伟创气体公司, 纯度为99.99%。实验用水来自国药集团化学试剂有限公司, 具体标准如表1所示, 由于水中杂质及融水成分极少, 在本实验中忽略不计。实验中人工海水采用配制的氯化钠(NaCl)溶液, 其具体成分如表2所示。数据采集系统包括温度、压力、流量等数据收集装置, 具体配置如表3所示。
| 表1 自来水参数 Table 1 Tap water parameters |
| 表2 实验用NaCl溶液质检参数 Table 2 Quality inspection parameters of the sodium chloride solution for experiment |
| 表3 数据采集系统配置表 Table 3 Data acquisition system configuration table |
实验流程:先配制实验所需的人工海水, 对反应釜进行清洗和干燥并加入9 L对应盐度的人工海水, 打开数据采集仪, 打开排气阀, 排尽系统内气体后连接真空泵, 开始抽真空; 启动恒温槽, 调节反应釜内水温为20℃, 再打开反应釜与CO2气瓶连接处阀门, 直至反应釜压力达到设定值并检查系统气密性; 分别先后启动系统冷却水水泵和系统压缩机; 当釜内达到一定条件, 水合物生成, 待反应釜入口水温达到0℃后, 先关闭压缩机, 再关闭冷却水水泵, 最后用盐度计检测釜内浓盐水浓度, 并导出实验数据; 采用不同的充注压力和初始盐度按表4设置了1 ~ 16组实验。
| 表4 实验方案 Table 4 Experimental scheme |
基于制冷系统动态循环, 提高水合反应速率, 利用制冷循环计算方法与水合反应式相结合, 在CO2充当制冷剂的过程中, 系统总制冷量为:
$\text{Q=}{{\text{q}}_{m}}\left( {{\text{h}}_{0}}-{{\text{h}}_{4}} \right)\cdot \tau $ (1)
CO2水合物生成需要系统提供一定的冷量, 此部分冷量由系统总制冷量提供, 在系统运行的过程中, 系统需要维持整个反应环境所需要温度, 还有其他的冷量损耗。故生成过程中消耗的总冷量为:
$\text{Q=}{{\text{Q}}_{h1}}+{{\text{Q}}_{w1}}+{{\text{Q}}_{h2}}+{{\text{Q}}_{r}}+{{\text{Q}}_{w2}}$ (2)
水合物反应中直接利用的冷能是水合物生成质量与单位水合物生成所需冷能相乘所得, 即:
${{\text{Q}}_{h1}}\text{=}\frac{{{\text{m}}_{h}}\Delta \text{H}}{1000}$ (3)
在水合反应之前, 釜内的冷量损耗为反应釜内初始盐水从20℃降温至水合物的相变温度时损耗的冷量, 即:
${{\text{Q}}_{w1}}\text{=}\frac{{{\text{m}}_{sw}}{{\text{c}}_{\text{p}, s1}}\left( {{\text{T}}_{1, w}}-{{\text{T}}_{h}} \right)}{1000}$ (4)
由于水合物生成结束后系统并不会马上停机, 继续会有多余的冷量输送至反应釜, 这也导致水合物还有进一步显热温降的冷量吸收, 即:
${{Q}_{\text{h2}}}\text{=}\frac{{{c}_{\text{h}}}{{m}_{\text{h}}}\Delta {{T}_{\text{h}}}}{1000}$ (5)
虽然反应釜通过保温棉与外界隔绝, 但反应釜釜体在降温过程中也会损耗一定的冷量, 即:
${{Q}_{\text{r}}}\text{=}{{m}_{\text{r}}}{{c}_{p\text{, r}}}\left( {{T}_{\text{2, r}}}-{{T}_{1\text{, r}}} \right)$ (6)
水合物生成后, 浓盐水降温至停机温度消耗的一定冷量${{Q}_{w2}}$, 可由下式表示:
${{\text{Q}}_{w2}}\text{=}\frac{\left( {{\text{m}}_{sw}}-{{\text{m}}_{w}} \right){{\text{c}}_{\text{p}, s2}}\Delta {{\text{T}}_{w}}}{1000}$ (7)
CO2水合反应方程式如下:
$\text{C}{{\text{O}}_{\text{2}}}\text{+}n{{\text{H}}_{2}}\text{O}\to \text{C}{{\text{O}}_{\text{2}}}\cdot n{{\text{H}}_{\text{2}}}\text{O+}\Delta H$ (8)
式中:n为水合数, 即水合物结构中水分子与CO2气体分子的个数比, 由于水合物的非化学计量化, n通常不为常数。本实验条件下取n = 7.67[14, 15]。
结合以上公式, 可以推出如下方程:
$\text{Q}=\frac{\left[ 1318.7\text{x}\Delta \text{H+}1318.7\text{x}{{\text{c}}_{h}}\Delta {{\text{T}}_{h}}+\left( {{\text{m}}_{sw}}-\text{x} \right){{\text{c}}_{\text{p}, s2}}\Delta {{\text{T}}_{w}} \right]}{1000}$(9)
求解所得水合反应消耗水的质量也是水合物分解所得的淡水质量。
海水淡化速率可由淡化水生成量与系统运行时间的比值表示:
${{\text{v}}_{w}}=\frac{{{\text{m}}_{w}}}{\tau }$ (10)
实验结束后的反应釜内浓盐水盐度可由盐度计测得, 淡化水盐度可由浓盐水盐度推算得出:
${{S}_{\text{c3}}}=\frac{\left[ {{m}_{\text{sw}}}\times {{S}_{\text{c1}}}\times 0.001-\left( {{m}_{\text{sw}}}-{{m}_{\text{w}}} \right)\times {{S}_{\text{c2}}}\times 0.001 \right]}{{{m}_{\text{w}}}}$(11)
盐去除率由下式计算:
${{\text{ }\eta\text{ }}_{s}}=\frac{{{\text{S}}_{c1}}-{{\text{S}}_{c3}}}{{{\text{S}}_{c1}}}\times 100%$ (12)
海水淡化成本计算由运转费用、维修费用和确定比例下的年投资分摊计算。实验中主要以其电力消耗计算系统年运转费用, 设备结构相对简单, 维修费用相对运行费用可以忽略不计。故通过压缩机功耗计算出的费用可以约等于年运转费用与维修费用之和。单位耗电量可以通过压缩机功耗得出:
$E=\frac{\text{w}}{1000\times 3600}$ (13)
淡化水成本为:
${{\text{c}}_{w}}=\frac{{{\text{C}}_{ye}}+3150}{{{\text{m}}_{t}}}$ (14)
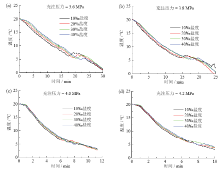
在不同的充注压力和不同的初始海水盐度下, 反应釜中层的温度变化曲线如图2所示。
由图2可知, 初始充注压力为3.6 MPa和3.8 MPa时, 不同盐度下釜内中层温度有明显的变化。温度突升表明水合物开始在釜内大量生成, 造成中层温度突升的原因是充注压力较低时, 充入釜内的制冷剂冷量较小, 经节流后所携带的冷量更小, 不能及时带走水合热, 导致在水合物生成处, 即反应釜中层位置有一个局部的温度突升。随着水合反应的进行, 釜内中层温度在达到最高点后开始下降, 由于釜内已生成大量的水合物, 在反应中后期水合物生成速度放慢, 产生的热量减少, 温度逐渐降低。
在初始充注压力为4.0 MPa和4.2 MPa条件下, 釜内中层温度变化明显, 这是由于随着充注压力的增大使得系统制冷能力提升, 制冷速率加快。虽然釜内中层温度也有一点突升, 但是注入釜内的CO2所携带的冷量及时带走了水合反应放出的热量, 使得突升的现象并不明显。分析曲线可知, 充注压力是水合物生成过程中的主导因素, 当充注压力逐渐增大时, 不同盐度曲线之间的温度差异减小。
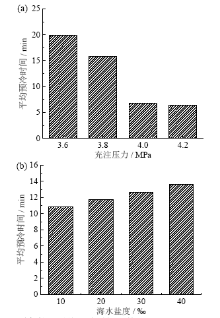
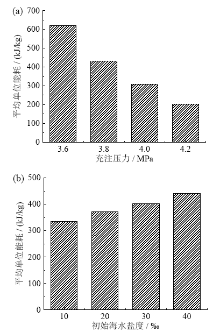
在不同的充注压力和初始海水盐度下, 水合反应的平均预冷时间如图3所示。
从图3a中可知, 水合物反应的平均预冷时间随着充注压力的升高而缩短, 当充注压力为3.6 MPa时, 平均预冷时间为19.92 min, 充注压力提升到4.2 MPa时, 平均预冷时间能缩短10 min以上。从图3b中可知, 水合物反应的平均预冷时间随着盐度的升高而延长, 当海水盐度为40‰时, 平均预冷时间最长, 为13.66 min, 当海水盐度为10‰时, 平均预冷时间最短, 为10.81 min。分析可知, 在水合物海水淡化过程中, 当压力大于4 MPa时能够大大缩短水合物反应的预冷时间, 并且选取盐度较低海域海水作为淡化水原料也能在一定程度上缩短预冷时间, 从而提高海水淡化效率。
2.3.1 压力和盐度对淡化水生成量的影响
在不同充注压力和海水盐度下的淡化水产量如图4所示。
由图4可知, 在海水淡化过程中, 淡化水生成量随着充注压力的升高而增大, 随着初始海水盐度的升高而减小。从曲线上升的趋势可以看出, 充注压力对淡化水生成量的影响更大。由此可以得出压力在水合物生成过程中起到主导作用。在其他条件一致的情况下, 压力越大越有利于水合反应的进行, 生成更多的水合物, 消耗更多的水, 使更多的淡水从盐水中被分离出来从而可以分解得到越多的淡化水。
2.3.2 压力和盐度对淡化速率的影响
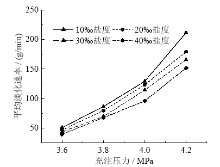
在不同充注压力和不同海水盐度下的海水淡化速率如图5所示。
由图5可知, 相同充注压力下, 初始海水盐度越大, 淡化速率越小。在相同海水盐度下, 充注压力越大, 海水淡化速率越快。在排除初始海水盐度因素的情况下, 充注压力对海水淡化速率有明显的促进作用, 即压力增大, 加快了水合反应的进行, CO2与水分子反应的驱动力也越大, 淡化速率越快。
2.3.3 压力和盐度对淡化水盐度的影响
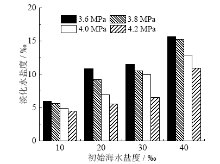
水合物法海水淡化生成的淡化水不能完全排除盐分, 淡化水中的盐分含量受到各种条件影响, 对淡化水进行盐度分析的结果如图6所示。
由图6可知, 增大充注压力加快了水合反应速率, 对水合物缝隙中的盐离子排出起到促进作用; 当海水盐度较高时, 水合物生成量变少, 即盐度对水合的生成有抑制作用, 影响最终水合物的生成量; 而且盐度过高会使生成的水合物夹带一部分的盐离子, 使得淡化水中的盐分增多。
2.3.4 压力和盐度对盐去除率的影响
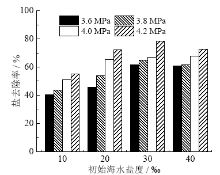
盐去除率是反映水合物法海水淡化脱盐能力的直观参数, 能够直接地表达出实验中对海水的去盐率的效果, 其结果如图7所示。
盐去除率受到充注压力的影响, 在给定初始海水盐度时, 充注压力越大, 盐去除率越大, 当充注压力为4.2 MPa时, 盐去除率达到最大。由于充注压力可以加快水合反应速率, 使得盐离子没有充足的时间进入水合物之间的缝隙, 从而明显地提高盐去除率。分析各压力段不同初始海水盐度下的盐去除率, 发现盐去除率与初始海水盐度不呈单调关系, 在充注压力3.6 MPa、3.8 MPa和4.2 MPa压力段, 初始海水盐度为30‰时盐去除率最大, 在充注压力4.0 MPa压力段, 初始海水盐度40‰时盐去除率最大; 总体而言, 在初始海水盐度为30% ~ 40‰阶段, 盐去除率相差不大, 此时初始海水盐度对其影响较小。本实验工况下, 充注压力对盐去除率影响最大。
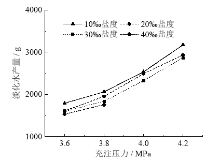
海水淡化的目的是获得淡水资源, 但是同时要保证尽可能地减少能耗, 因此有必要对海水淡化的实验结果进行能耗分析。在实验中, 不同的初始压力以及盐度下淡化水产量不同, 单位能耗变化较大, 分析数据得出不同充注压力和不同初始海水盐度下的平均单位能耗如图8所示。图8a和图8b分别显示了不同充注压力和不同海水初始盐度下的单位能耗。通过比较不同充注压力下四组不同初始海水盐度的平均单位能耗, 可知其他条件一致的情况下, 充注压力越大, 淡化水所需单位能耗越小。这是由于充注压力的增大加快了系统制冷速率, 增大了系统制冷量, 缩短降温时间, 淡化水产量也越高, 故单位能耗减小。其他条件一致的情况下, 初始海水盐度越大, 淡化水能耗越大。这是由于初始海水盐度的增大阻碍了水合反应的进行, 生成水合物的量减少, 所得的淡化水也越少, 增大了单位能耗。
实验过程中能耗过高会导致淡化水的价格过高, 主要原因包括:①水合物反应会放出大量的热量, 排出这些热量需要消耗压缩机的制冷量; ②制冷剂节流会消耗大量的能量; ③反应釜是个不锈钢体, 反应的整个过程会吸收压缩机的制冷量; ④水合物法海水淡化尚处在实验阶段, 淡化技术和工艺流程不成熟导致过多的能量损耗。
采用CO2水合物海水淡化方法, 通过实验分析计算了压力以及海水盐度对海水淡化量的影响, 分别对水合反应预冷时间、淡化水产量、淡化速率、淡化水盐度、盐去除率以及单位能耗进行了分析。结果表明, 压力能够打破水合物和海水之间的相平衡, 压力越大, 海水淡化的质量越高。随着盐度升高, 水合反应预冷时间越长, 淡化水产量越低, 淡化速率越慢, 淡化水盐度越高, 盐去除率越高。盐度在一定程度上影响海水淡化的效果, 原因是海水中盐离子会影响水合物的生成, 导致海水淡化的质量不高。
水合物法海水淡化技术是一种具有工业前景的新兴的海水淡化技术。随着水合物技术的发展和海水淡化工艺流程的不断完善, 将来在大型化的海水淡化工厂进行水合物法海水淡化生产的价格会在人们可接受的范围内。作为一种新的海水淡化技术, 为人类在解决淡水资源短缺的问题上提供新的思路和方法, 从而缓解当今世界淡水资源短缺的问题。本研究结果可为今后水合物法海水淡化提供参考。
符号表:
| Q | 系统总制冷量, kJ |
| qm | CO2质量流量, kg/s |
| h0 | 反应釜出口焓值, kJ/kg |
| h4 | 反应釜入口焓值, kJ/kg |
| $\tau $ | 运行时间, s |
| Qh1 | 水合物生成净利用冷量, kJ |
| Qw1 | 釜体盐水降至反应温度所损耗冷量, kJ |
| Qh2 | 水合物温度降至系统运行终止温度损耗冷量, kJ |
| Qr | 釜体钢结构损耗冷量, kJ |
| Qw2 | 水合反应后浓盐水降温至系统运行终止温度所损耗冷量, kJ |
| mh | 水合物生成质量, g |
| △H | 每千克水合物生成所需冷能, 500 kJ/kg |
| msw | 反应釜内充注盐水质量, g |
| cp, s1 | 初始盐水的比热容, kJ/(kg·℃) |
| T1, w | 反应釜内盐水初始温度, 20℃ |
| Th | 水合物的生成温度, ℃ |
| ch | CO2水合物比热容, 2.7 kJ/(kg·℃)[16] |
| △Th | 水合物继续降温过程的温差, ℃ |
| Qr | 反应釜釜体温降损耗冷量, kJ |
| mr | 反应釜釜体质量, 54 kg |
| cp, r | 反应釜釜体钢结构比热容, 0.5 kJ/(kg·℃) |
| T1, r | 停机时反应釜釜体温度, ℃ |
| T2, r | 开机时反应釜釜体温度, ℃ |
| mw | 水合反应消耗水的质量, 即淡化水量, g |
| cp, s2 | 反应后浓盐水的比热容, kJ/(kg·℃) |
| △Tw | 浓盐水继续降温过程温差, ℃ |
| vw | 海水淡化平均速率, g/min |
| Sc1 | 初始海水盐度, ‰ |
| Sc2 | 浓盐水盐度, ‰ |
| Sc3 | 淡化水盐度, ‰ |
| E | 系统单位耗电量, kW· h/t |
| cw | 淡化水成本, 元/t |
| Cye | 年运转费用, 元 |
| mt | 年总产水量, t |
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|