作者简介:李 康(1996-),男,硕士研究生,主要从事清洁燃烧与CO2减排研究。郑 敏(1980-),女,博士,副教授,主要从事化学链燃烧方面研究。
基于吉布斯最小自由能原理,对铜基载氧体前驱体燃烧合成过程进行平衡模拟计算。预测了固体产物状态和气体产物分布。通过改变原料配比,计算绝热燃烧温度,判断反应能否自我维持。结果表明,在加入物料为化学计量比的反应条件下,平衡绝热燃烧温度 Tad为2 300 ~ 2 400℃,燃烧能自我维持。在加入物料为非化学计量比,尿素小于0.2倍理论加入量时,该燃烧不能自我维持,尿素小于0.5理论加入量时,含Cu化合物以液相形式存在。该体系中NO是NO x的主要成分,随着尿素的增加,NO含量先快速增加后减少,当尿素占比为0.71时,NO含量达到极值。过量尿素的加入会使NO还原为N2。
Based on principle of minimum Gibbs free energy, the combustion synthesis process of copper oxygen carrier precursor was simulated. Solid product states and gas product distributions were predicted. The adiabatic combustion temperature was calculated by changing the ratio of raw materials to determine whether the reaction was self-sustaining. The results showed that the temperature of balanced adiabatic combustion was 2 300 - 2 400oC and the combustion was maintained by itself under the condition of chemical stoichiometric ratio. When the material was non-stoichiometric and urea was less than 0.2 times of the theoretical amount, the combustion was not self-sustained. When urea was less than 0.5 times of the theoretical amount, Cu-containing compounds existed in liquid form. NO was the main component of NO x in the system, which increased rapidly at first and then decreased with the increase of urea. When the proportion of urea was 0.71, the amount of NO reached the extreme value. The addition of excess urea can reduce NO to N2.
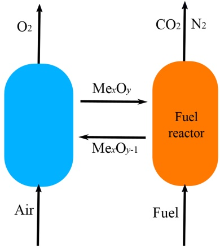
化学链燃烧(chemical looping combustion, CLC)是一种能够高效捕集CO2的新型燃烧技术, 其基本工艺装置主要是由燃料反应器(fuel reactor, FR)和空气反应器(air reactor, AR)组成。在一定温度条件下, 载氧体首先在空气反应器中与空气发生氧化反应, 从空气中分离出O2。经过氧化反应的载氧体携带氧气通过底部的旋风分离器进入燃料反应器内, 释放出O2与燃料(煤/生物质)发生还原反应, 金属氧化物被还原为金属, 进入到空气反应器中循环使用, 燃烧后的气体产物为CO2和H2O。CLC工艺流程如图1所示。
在众多载氧体中, Cu基载氧体具有较高反应速率和优异的晶格氧传递能力, 能够将碳氢燃料充分地转换为CO2和H2O且过程不受热力学限制。为了增强Cu基载氧体在化学链燃烧循环中的反应性能, 选取了Al2O3、膨润土、CuAl2O4、MgO、MgAl2O4、海泡石、SiO2、TiO2和ZrO2等多种材料作为CuO的惰性载体, 采用机械混合、共沉淀、喷雾干燥、冷冻制粒和浸渍等多种不同的制备方法制备不同的铜基载氧体[1]。在采用Al2O3作为惰性载体的研究中, 发现CuO与Al2O3相互作用生成CuAl2O4[2, 3, 4]。CuAl2O4虽然在还原过程中可以被完全还原, 并且可以在较低的氧分压和高温条件下释放出氧, 但其反应速率远低于CuO的还原反应[5]。在所有惰性载体和制备方法中, 铜基载氧体均表现出很高的反应性。通过在SiO2、TiO2或Al2O3上浸渍[6, 7, 8]或与Al2O3共沉淀制备的载氧体都具有出色的化学稳定性, 且在多次循环试验后仍保持良好的机械强度。然而, 采用其他载体或制备方法的铜基载氧体在循环实验中[8]表现出明显的机械性能下降。
魏义杰[9]在制备Cu基载氧体的过程中加入尿素作为分散剂, 而且尿素与硝酸根反应降低了铜基载氧体在煅烧过程NOx的排放, 实现了载氧体的绿色制备。XU等[10]利用热重红外联用对Cu基载氧体前驱体的煅烧过程进行研究, 发现Cu基载氧体前驱体在煅烧过程中, 加入尿素时NOx的释放量远远低于不加入尿素的Cu铜基载氧体。郑华德等[11]利用自蔓延燃烧法制备CuCr2O4亚微米晶, 实验结果表明过量的还原剂可以抑制NOx的生成。LI等[12]研究了分别使用柠檬酸、甘氨酸、丙氨酸、尿素和卡巴肼五种不同燃料或络合剂对于γ -LiAlO2的影响。与柠檬酸不同的是, 其他4种燃料都含有氨基, 不仅能够络合金属离子, 而且能在相当低的温度下生成氨气。氨气可以与硝酸盐在热处理过程中分解出的NOx发生反应, 生成N2和H2O。
载氧体前驱体煅烧反应过程中, 主要会发生自蔓延燃烧反应, 并释放出热量。本文通过载氧体前驱体燃烧体系的热力学计算分析, 旨在判断燃烧反应能否自我维持, 预测燃烧产物的状态, 主要任务是计算绝热燃烧温度(Tad)和燃烧产物的平衡成分。
通过计算燃烧反应的放热量以及体系的绝热温度, 从而判断反应体系是否发生、反应的趋势、反应是否能自维持、反应产物相态变化等。对于某一个反应, 其能自发进行的必要条件为式(1):
$\Delta {{G}_{T}}=\sum{{{n}_{i}}{{({{G}_{T}})}_{i, p}}-}\sum{{{n}_{j}}{{({{G}_{T}})}_{_{j, R}}}< 0}$ (1)
其中:$\Delta {{G}_{T}}$为温度T时体系的吉布斯自由能; ${{n}_{i}}$、${{n}_{j}}$分别为第i种反应物质的量和第j种生成物质的量; ${{({{G}_{T}})}_{i, p}}$为第i种反应物在温度T时的自由焓; ${{({{G}_{T}})}_{_{j, R}}}$为第j中产物在温度T时的自由焓; P为反应产物; R为反应物。
对于多组元体系, 由于反应物不唯一, 反应按自由焓最低的方向进行。
吉布斯自由能又称吉布斯函数, 是指在封闭体系内不做非体积功的前提下, 任何自发反应总是朝吉布斯自由能减小的方向进行, 而化学势则等于体系的吉布斯自由能除以体系的粒子总数。吉布斯反应器(RGibbs)模块中混合物的吉布斯自由能$\overline{G}$可以采用下述方程式描述:
$\overline{G}=\sum\nolimits_{i=1}^{N}{{{n}_{i}}{{G}_{i}}}$ (2)
其中:ni为体系中第i组分的摩尔量; N为体系组分的总个数; Gi为第i组分的化学势。Gi可以描述为式(3)和式(4):
${{G}_{i}}=G_{i}^{0}+RT\ln \frac{{{f}_{i}}}{f_{i}^{0}}$ (3)
${{f}_{i}}=\frac{{{n}_{i}}}{\sum\nolimits_{i=1}^{N}{{{n}_{i}}}}{{\varphi }_{i}}P$ (4)
其中:$G_{i}^{0}$为第i种组分在标准状态下的化学势; fi为第i种组分在混合中的逸度; φ i为第i种组分的组分逸度系数; P为组分压力; $f_{i}^{0}$为标准状态下第i种组分的逸度; R为标准状态下的气体常数; T为体系的绝热温度。
当吉布斯自由能为最小时, 体系达到平衡, 即:
${{\overline{G}}_{\text{min}}}=\sum\nolimits_{i=1}^{N}{{{n}_{i}}{{G}_{i}}}$ (5)
体系在反应前后需要达到质量平衡与能量平衡。质量平衡与能量平衡可以通过式(6)和式(7)表示:
$\sum\nolimits_{i=1}^{N}{{{n}_{i}}{{\beta }_{ij}}={{B}_{ij}}}$ (6)
$\sum\nolimits_{i=1}^{N}{{{n}_{i}}}{{H}_{i}}=Q$ (7)
式中:${{\beta }_{ij}}$为第i种组分中反应前后原子个数; ${{B}_{ij}}$为反应前原子个数; Hi为反应后第i种组分的能量; Q为反应后的能量。
铜基载氧体中以尿素和聚乙烯醇作为燃料, 其中聚乙烯醇是一种长链分子物质, 结构复杂。Aspen plus软件在处理这类物质时, 常将其视为非常规物质处理, 通过属性组分表征。一般情况下, 聚乙烯醇可以由元素分析来表征。本文采用Aspen plus中RYield的热解单元将聚乙烯醇热解为简单组分(C、H2、CO2、O2), 通过Fortran子程序实现。
对于载氧体前驱体的燃烧合成反应, 硝酸盐Cu(NO3)2为氧化剂, 而尿素CO(NH2)2和聚乙烯醇(C2H4O)n为还原剂, 假设空气不参与燃烧反应。燃烧反应的氮源有尿素和铜的硝酸盐, 并假设含氮物质(硝酸盐与尿素)燃烧后的产物为N2, 化学当量比条件下的燃烧反应方程如下:
$\begin{align}& {{\left( {{\text{C}}_{\text{2}}}{{\text{H}}_{\text{4}}}\text{O} \right)}_{n}}+{{x}_{2}}\text{CO}{{\left( \text{N}{{\text{H}}_{\text{2}}} \right)}_{2}}+ \\ & \text{ Cu}{{\left( \text{N}{{\text{O}}_{\text{3}}} \right)}_{2}}+{{y}_{1}}\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}+{{y}_{2}}\text{Ti}{{\text{O}}_{\text{2}}}=\text{ } \\ & \text{CuO }+{{x}_{3}}\text{C}{{\text{O}}_{\text{2}}}+{{x}_{4}}{{\text{H}}_{\text{2}}}\text{O }+{{x}_{5}}{{\text{N}}_{\text{2}}}+{{y}_{1}}\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}+{{y}_{2}}\text{Ti}{{\text{O}}_{\text{2}}} \\ \end{align}$ (8)
根据元素守恒、质量守恒, 得到:x1= x1; x2= (5 - 5nx1)/3; x3= (5 + nx1)/3; x4= (10 - 4nx1)/3; x5= (8 - 5nx1)/3。
在该燃烧过程, 硝酸盐Cu(NO3)2提供的氧能够支持还原剂充分燃烧, 生成CO2、H2O和N2。
基于吉布斯自由能最小化原理, 采用Aspen plus软件对载氧体前驱体自蔓延燃烧反应进行平衡模拟。CuO在1 086℃时热分解, Cu2O在1 236℃时熔化, Cu在1 084℃时发生固-液相转化等。Cu基载氧体自蔓延燃烧反应过程还应考虑产物的相态变化等。因此该反应过程非常复杂。
以化学当量比加入物料Cu(NO3)2(氧化剂)、聚乙烯醇 (C2H4O)n(燃料)和尿素CO(NH2)2(还原剂)、Al2O3和TiO2。同时, 改变燃料中聚乙烯醇与尿素的比例。计算获得不同燃料配比下, 反应达到平衡状态时, 系统的绝热燃烧温度, 体系中固相、液相所占比例和平衡产物组成。模拟计算结果如图2a ~ 图2c所示。
图2a显示了该体系发生自蔓延合成(self-propagpation high-temperature synthises, SHS)反应时的Tad和气体产物分布情况。体系绝热燃烧温度Tad随着燃料中尿素含量增加而呈线性降低, Tad为2 300 ~ 2 400℃, 高于MERZHANOV等[13]提出的高温SHS燃烧波自维持的热力学判据(Tad > 1 527℃时, 燃烧波才能自维持下去), 该燃烧能自我维持。体系绝热燃烧温度高于CuO热分解点、Cu2O和Cu的熔点, 但是低于Cu的沸点(2 575℃), 含铜物质以液相形式存在。
图2b和图2c展示了随着尿素的增加, 气体产物中含氮气体的分布。该体系发生SHS反应时, NO是最主要的NOx。含氮气体产物组分在干气体产物中的相对含量分布如下:NO < 0.020 4, NO2< 0.000 01, N2O < 0.000 001, 基本无NH3。载氧体前驱体中的Cu(NO3)2和燃料中CO(NH2)2的氮元素均会转化成NO。增加燃料中尿素含量, NO浓度先快速增大再减少, 在尿素份额占比约0.71时, 达到极大值。
固定聚乙烯醇(15 g)、三水硝酸铜(471 g)、氧化铝(35 g)和氧化钛(10 g)加入量, 改变尿素加入量。按照化学当量比反应时, 当聚乙烯醇加入量为15 g, 理论尿素加入量为80.521 g。现改变尿素加入量为0.2 ~ 3倍的当量加入量(理论尿素加入量), 进行平衡模拟计算分析。
图3a ~ 图3c显示了不同尿素加入量条件下的Tad和平衡气体产物分布。增加尿素量, 一方面, 提高了Tad, 不仅促进了硝酸铜分解生成NO, 而且促进了CuO分解释放出O2, 进而有利于尿素氧化生成CO2、H2O和NO; 另一方面, 尿素高温热分解成H2、CO和N2是强吸热反应。过量尿素以及其高温热分解产物H2和CO, 还会与NO反应, NO还原成N2, 减少了NO的释放。
图3d显示了在不同尿素加入量下含Cu化合物的存在形式。尿素加入量小于 0.5倍理论加入量时, 体系绝热温度Tad低于维持自蔓延燃烧波的理论温度, 燃烧不能自我维持; 尿素加入量小于0.2倍时, 固体产物为CuO; 0.4倍理论尿素加入量时, 绝热燃烧温度约为1 487℃, 生成液相Cu2O; 继续增加尿素量, Cu的化合物以液相形式存在。
范宝山等[13]通过在多工位管式炉中对不同尿素加入量的铜基载氧体前驱体进行程序升温实验, 获得了煅烧过程中氮氧化物的释放规律。实验结果表明, 随着尿素加入量的增加, 氮氧化物释放浓度发生改变, NO为主要的氮氧化物, NO2浓度随着尿素的增加, 先增大后减小。本文模拟计算结果与实验结果基本吻合。本文模拟计算结果可以为载氧体绿色制备提供理论参考。
基于吉布斯自由能最小化原理, 采用Aspen plus软件对铜基载氧体前驱体自蔓延燃烧反应进行平衡产物分析。在化学计量比与非化学计量比两种反应条件下, 分别计算了载氧体在平衡状态时绝热燃烧温度Tad和平衡产物分布, 获得以下结论:
(1)以化学计量比加入物料时, 体系Tad随燃料尿素的增加而降低, Tad为2 300 ~ 2 400℃, 燃烧能够自我维持, 这时含铜物质以液相形式存在。
(2)在非化学计量比反应条件下, 小于0.5倍尿素理论加入量时, 体系绝热温度低于自蔓延燃烧理论温度, 反应不能自我维持; 小于0.2倍理论加入量时, 固体产物为CuO; 0.4倍理论尿素加入量时, 绝热燃烧温度约1 487℃, 生成液相Cu2O; 进一步增加尿素量, 含Cu化合物以液相形式存在。
(3)NOx中最主要的成分是NO, 载氧体前驱体中的Cu(NO3)2和燃料中CO(NH2)2的氮元素均会转化成NO。增加燃料中尿素量, NO浓度先快速增大再减小, 尿素份额占比约0.71时, 达到极大值。
(4)随着尿素加入量的增加, 过量尿素及其高温热分解产物H2和CO, 还会与NO反应, NO还原成N2, 减少了NO的释放。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|