作者简介:陈 帅(1998-),男,硕士研究生,主要从事锂离子电池电解液添加剂方面的研究。李伟善(1962-),男,博士,教授,博士生导师,主要从事电化学储能材料与技术基础与应用研究。
锂离子电池商业化应用已有30多年,但目前的电池性能仍不能满足社会发展的需求。为此,须不断开发高性能的电池材料。电化学测量是电池材料开发不可或缺的关键技术。锂金属电极是锂离子电池电化学测量中最常用的参比电极,其电位稳定性将影响电化学测量结果的准确性。报道一种能提高锂金属参比电极电位稳定性的锂金属表面处理方法。将有机锌盐和氟代碳酸酯的混合溶液滴加在锂金属表面,通过锂金属与溶液组分的反应,在锂金属表面形成一层含锌锂合金和氟化锂的混合界面膜,可降低锂溶解/沉积过电位。处理得到的锂金属电极在Li//Li对称电池中用1 mA/cm2的电流及1 mA∙h/cm2的容量恒电流连续充放电,该对称电池的电压稳定时间是未处理电池的2倍以上。这种锂金属电极表面处理方法可提高电极材料电化学性能测量的稳定性,有利于锂离子电池新材料的开发。
Despite being used in commercial applications for more than 30 years, lithium-ion batteries’ current performance is insufficient to enable social advancement. Therefore, high-performance battery materials must be continuously researched. Electrochemical measurement is a key technology in the creation of battery materials. Lithium metal electrodes are the most frequently used reference electrodes in electrochemical studies of lithium-ion batteries, and their potential stability will affect the correctness of the results. In this work, a procedure for modifying the surface of lithium metal that can improve the potential stability of the lithium metal reference electrode was described. A mixed interface film containing zinc lithium alloy and lithium fluoride was formed on the surface of lithium metal through the reaction of lithium metal with solution components, which could lessen the overpotential of lithium dissolution/deposition. The mixed solution of organozinc salt and fluorocarbonate was added dropwise to the surface of lithium metal. In a Li//Li symmetrical battery with a current of 1 mA/cm2 and a capacity constant current of 1 mA∙h/cm2, the processed lithium metal electrode was continuously charged and discharged, and the voltage stability time of the symmetrical battery was more than twice that of the untreated battery. This lithium metal electrode surface treatment technique can increase the stability of the electrode material’s electrochemical performance measurement, which is helpful for the creation of novel lithium-ion battery materials.
人类为摆脱能源短缺危机并不断提升生活水平, 一直努力开发高效的能源转换与储存技术。锂离子电池是迄今为止能量密度最高的电化学储能装置[1], 同时具有工作输出电压高、自放电小、无记忆效应等优点, 已在3C电子设备、移动基站、电动汽车等领域得到了广泛的应用[2, 3]。随着社会的快速发展, 人们对锂离子电池的性能不断提出更高的要求。例如, 为高寒地区移动设备提供电力需要发展低温锂离子电池, 为延长电动汽车的续航里程需要发展高能量密度锂离子电池, 为保证生命和财产的安全需要发展高安全锂离子电池等。为满足这些需求, 需要对现有锂离子电池材料体系的工作原理有更深刻的认识, 进而开发新的电池材料, 包括电解液、隔膜、正负极材料等[4, 5]。电化学测量是这些研究工作不可或缺的关键技术[6]。锂金属电极是锂离子电池研究中最常用的参比电极, 其电极电位的稳定性将影响电化学测量结果的准确性[7, 8]。
在锂离子电池材料研究的电化学测量中, 通常采用二电极和三电极电解池。锂(Li)金属电极在二电极电解池中既作为对电极又作为参比电极, 在三电极电解池中仅作为参比电极。锂金属电极作为参比电极, 要求其电极电位具有良好的稳定性。在二电极电解池中, 锂金属电极同时作为对电极, 电流通过时, 会发生锂金属溶解/沉积过程。若锂金属的溶解/沉积过程不可逆, 锂金属电极表面性质就可能发生变化, 影响参比电极电位的稳定性[9]。例如, 不受控制的锂沉积易导致锂枝晶生长, 从而破坏原有的固体电解质界面(solid electrolyte interphase, SEI)膜, SEI膜的不断破坏与修复会导致其厚度不断增加, 电流通过时参比电极会产生额外的过电位。在三电极电解池中, 因锂金属的活性很强, 易与电解液反应, 锂金属氧化溶解而电解液还原分解, 改变了锂金属表面的性质及电极电位, 进而影响了电化学测量的准确性。针对锂金属的高活性问题, 一些研究采用贵金属如银、金作为锂离子电池材料研究的参比电极[10, 11, 12]。显然, 这类金属材料在电池测试过程中电极电位会由于电化学变化而产生明显的电位漂移, 进而不能提供准确的电化学信息。为提高电极电位的稳定性, 一些锂合金如锂铝[14, 15]、锂锡[16, 17]、锂铋[18]、锂铟[19, 20]、锂金[11]等相继被提出作为参比电极。但是, 这些合金用在二电极电解池中时, 锂金属的溶解/沉积过程会引起体积变化, 产生的局部应力容易破坏电极的结构, 影响电极电位的稳定性[21]。锂金属电极的初始界面性质对其电位稳定性起着关键作用, 对锂金属电极的界面改性有望改善锂金属电极的稳定性[22]。
锂金属表面预钝化技术在锂金属负极研究领域是一种重要的界面改性策略, 此策略是在锂金属表面预先形成一层钝化层, 可以提高锂金属电极的电位稳定性。例如, 采用氟代碳酸乙烯酯(fluoroethylene carbonate, FEC)作为溶剂的电解液, 可在锂金属表面形成富含氟化锂(LiF)的钝化层, 提高锂金属的稳定性[23, 24]; 采用电解液添加剂, 可以在电极表面形成含有机组分的界面膜, 从而提高锂金属电极的稳定性[25]。此外, 在金属表面沉积其他金属, 可降低锂金属溶解/沉积的过电位, 从而提高锂金属电极的循环稳定性[25, 26]。这些研究为解决锂金属参比电极的不稳定性问题提供了新思路。
基于构建表面保护膜的思路, 提出一种提高锂金属参比电极稳定性的简便方法。以三氟甲烷磺酸锌[zinc trifluoromethanesulfonate, Zn(OTF)2]为盐[27]、FEC与二甲醚(1, 2-dimethoxyethane, DME)为溶剂的溶液, 滴加在锂金属表面, 形成特殊结构的界面膜。由于Zn(OTF)2易溶于由FEC和DME组成的混合溶剂中, 锂金属首先与Zn(OTF)2发生置换反应, 置换出的锌单质与锂金属结合形成锌锂合金(LiZn), 随后与FEC反应, 形成LiF, 构成界面膜的主要组分。合金组分提供低过电位的锂溶解/沉积点; 而LiF对合金及锂基体起到保护作用, 从而显著提高锂金属参比电极的稳定性。
锂金属参比电极的制备及电池的组装均在充满氩气的手套箱内进行(H2O < 7.5 × 10-6 g/m3, O2< 1 × 10-5 g/m3)。如图1所示, 将80 µ L含0.05 mol/L Zn(OTF)2的DME-FEC溶液(DME和FEC体积比为1∶ 1)滴在锂金属片(厚度为550 µ m、直径为12.5 mm, 购自中国能源锂业有限公司)表面, 保持10 min后用纯碳酸甲乙酯(ethyl methyl carbonate, EMC)冲洗三遍, 自然晾干, 得到锂金属片电极(Li-Zn-LiF)。用于评估参比电极应用效果的钴酸锂(LiCoO2)电极制备方法如下:将LiCoO2、乙炔黑和聚偏氟乙烯黏合剂以8∶ 1∶ 1的质量比混合在N-甲基-2-吡咯烷酮中, 充分搅拌均匀, 用刮刀将浆料涂覆到铝箔上, 在温度为120℃的烘箱中真空干燥12 h后切成圆形电极片(直径为12 mm)。
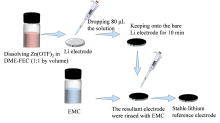 | 图1 制备锂金属参比电极的流程图Fig. 1 Schematic illustration on the preparation of lithium metal reference electrode |
所有实验均采用二电极体系的2025型扣式电池。对称电池用相同的锂金属电极, 非对称电池以LiCoO2为正极, 锂金属为对电极和参比电极。Celgard 3501作为隔膜。使用的液体电解液体积为80 µ L。电解液配制方法如下:将六氟磷酸锂溶解在体积比为1∶ 4的碳酸乙烯酯(ethylene carbonate, EC)和EMC的混合溶剂中, 六氟磷酸锂浓度为1 mol/L。
充放电循环测量采用蓝电电池测试仪(CT2001A, 武汉蓝电电子股份有限公司)。Li//Li对称电池以电流密度为1 mA/cm2、容量为1 mA∙ h/cm2进行充放电循环; Li//LiCoO2电池在3 ~ 4.2 V(相对于Li/Li+电极, 如无特殊说明, 均指相对于Li/Li+电极)的电位范围内, 先以0.3 C(1 C = 140 mA∙ h/g)的电流循环三圈, 再以1 C的电流连续循环。电化学阻抗谱(electrochemical impedance spectra, EIS)是在Li//Li称电池组装5 h后, 采用电化学工作站(PGSTAT- 30 Autolab Metrohm, 荷兰)的测量结果, 交流电幅值为10 mV, 频率为 100 kHz ~ 0. 1 Hz。
采用X射线衍射仪(X-ray diffractometer, XRD)(Bruker D8 Advanced, 德国)、透射电子显微镜(transmission electron microscope, TEM)(FEI Tecnai G2 F20 S-Twin, 美国)分析锂金属表面膜组成。
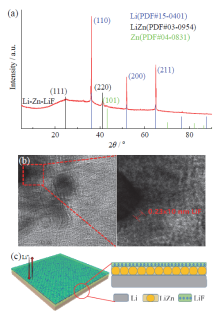
锂金属的活性很强, 易与接触的电解液反应, 将电解液组分还原, 所得沉积物在锂金属表面沉积形成保护层。对制备的锂金属参比电极(Li-Zn-LiF)进行XRD分析, 结果如图2a所示。对照晶相标准卡可以看出, 图中除了有锂金属的特征衍射峰外, 还具有(111)和(220)的锌锂合金(LiZn)特征峰以及(101)的金属锌特征峰。说明锂金属表面形成了含LiZn的表面层。当以Zn(OTF)2为锂盐、FEC和DME为混合溶剂的溶液滴加在锂金属表面时, 由于Zn(OTF)2的最低未占据分子轨道(lowest unoccupied molecular orbital, LUMO)能最高, 锂金属首先与Zn(OTF)2反应, 将溶液中的锌离子置换出来[27], 锌有很强的亲锂性, 置换出来的金属锌与锂结合形成LiZn[28]。随后锂金属与FEC反应, 生成LiF。高分辨率TEM分析结果证实LiF的存在, 如图2b所示。因此, 制备得到的Li-Zn-LiF参比电极具有特殊化学组成的表面膜, 主要由LiZn合金内层和LiF外层组成, 如图2c所示。内层的LiZn合金因锌的高亲锂性赋予锂金属电极的可逆锂溶解/沉积能力, 减少其用作二电极电解池的参比电极的极化; 外层的LiF由于稳定的化学性质, 对LiZn合金及锂金属基体起到保护作用, 提高锂金属参比电极的稳定性。这种电极制备方法也可能生成混合离子导体层[29], 有利于降低界面电阻。
由于锂金属的高活性, 未被保护的参比电极会与电解液组分发生反应, 形成较厚的界面膜, 即使在无电流通过的三电极电解池中应用, 也会因建立界面膜的过程, 使其电位不稳定[30]。锂参比电极在二电极电池中进行极化条件下测量时, 会有电流通过, 界面膜的存在可能会增加电极的极化, 改变参比电极电位[31]。Li-Zn-LiF参比电极的特殊表面化学组成, 既促进了锂金属溶解/沉积的可逆性, 减小电极极化, 又能保护锂金属不被电解液腐蚀, 提高电极的稳定性, 可以满足锂金属参比电极不同情况下电化学测量的电极电位稳定要求。
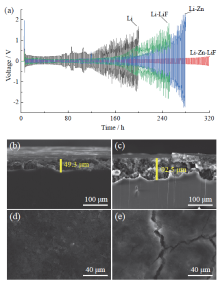
为了考察所制备Li-Zn-LiF参比电极的可逆性及稳定性, 组装了Li//Li对称电池, 进行充放电循环, 并与未处理的锂金属电极进行比较, 得到的结果如图3a所示。从图3a可以看出, 前几次循环极化电位较高, 尤其是未处理的锂金属电极。这一现象与电极的初始状态有关。未处理的电极浸入电解液后会与电解液持续反应, 形成高阻抗的界面膜, 随着充放电循环的进行, 锂的沉积增大了电极的表面积, 同样的电流下, 极化电位降低。Li-Zn-LiF的极化电位较低, 说明该电极表面的化学组成对锂金属有保护作用。未处理的电极经80 h后, 极化电位随循环次数增加而显著增大, 并在150 h以后出现电位振荡。极化电位随循环次数增大说明界面不稳定, 电位振荡与电池微短路有关。由于锂金属的高活性, 不施加保护的情况下, 易与电解液的溶剂及锂盐发生反应, 锂金属被氧化溶解而溶剂和锂盐被还原分解, 生成气体、可溶物及沉积物等, 阻碍了锂离子在电极/电解液界面上的传输, 增大了界面电阻。电极充放电循环过程中, 这些副反应继续进行, 界面电阻随之增大, 电极电位随之升高, 锂金属溶解/沉积的可逆性变差。由于在电极表面上的沉积物不均匀, 存在局部裸露的区域, 锂离子易优先在该区域沉积, 形成锂枝晶, 产生微短路现象。显然, 未经处理锂金属电极的可逆性和稳定性均不佳, 用作参比电极进行电化学测量时易产生误差。而使用含Zn(OTF)2溶液和FEC溶液处理的锂金属电极(Li-Zn、Li-LiF)稳定性相对于未处理的锂金属电极有较大的提升, 其分别在180 h和200 h开始出现电位震荡。在含Zn(OTF)2和FEC的溶液处理的锂金属电极(Li-Zn-LiF)表现出更加良好的可逆性和稳定性。在相同条件下进行充放电池循环, Li-Zn-LiF电极比未处理的锂金属电极电位极化值小, 充放电循环320 h后仍未出现电位振荡现象, 表明锂金属与滴加溶液相互作用后形成的界面膜具有保护作用, 并且界面膜的存在不会增加界面电阻。
为进一步证明保护层对锂电极表面产物的影响, 在充放电电流密度为2 mA/cm2、容量为1 mA∙ h/cm2的条件对Li//Li对称电池进行充放电循环, 循环100圈后取出电极进行截面和表面扫描电子显微镜(scanning electron microscope, SEM)观察, 如图3b ~ 图3e所示。与未处理的锂电极(图3c、图3e)相比, Li-Zn-LiF电极(图3b、图3d)呈现较薄的表面层及较光滑的表面, 说明Li-Zn-LiF电极的表面层对锂基体有保护作用。
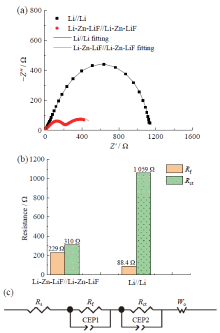
Li-Zn-LiF电极的低界面电阻特性可通过电化学阻抗测量进一步证实。图4a的点谱是锂金属电极处理前后在Li//Li对称电池中得到的阻抗测量值。测量值可以用图4c的等效电路图拟合。等效电路中, Rs为电池的欧姆电阻, Rf为界面膜电阻, Rct为电荷传递电阻。用该等效电路拟合测量值得到图4a的线谱与测量值非常吻合。因电池的结构和电解液均相同, 电极处理前后组装的对称电池Rs相同。
不同的是界面电阻(Rf + Rct), 如图4b所示, 处理后的Li-Zn-LiF电极具有远小于未处理的Li电极的界面电阻, 说明锂金属电极经含Zn(OTF)2和FEC的溶液处理后, 能显著降低界面电阻。高界面阻抗的参比电极在二电极电解池中进行有电流通过的电化学测量时, 得到的电极电位比真实的电极电位更大, 产生较大的测量误差, 本文提出的电极制备方法可以解决这一问题。
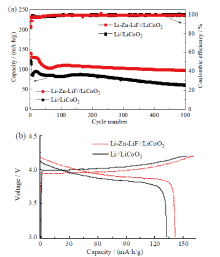
为验证制备的Li-Zn-LiF电极的应用效果, 用处理前后的锂金属电极作为负极和参比电极与LiCoO2正极组装成电池, 进行充放电循环性能测量, 充放电电压范围为3 ~ 4.2 V, 前三圈电流为0.3 C, 后续循环电流为1 C, 得到的结果如图5所示。
由图5a可以看出, 锂金属电极经含Zn(OTF)2和FEC的溶液处理后, 对二电极电解池的LiCoO2电极循环性能测量结果影响很大。如图5b所示, 使用Li-Zn-LiF参比电极的电池, LiCoO2的初始放电容量为141.13 mA∙ h/g, 比未处理锂金属参比电极的容量(132.04 mA∙ h/g)高出9.1 mA∙ h/g, 对应的库仑效率分别为88%和86%。这一差异说明处理后的锂金属电极上的副反应减少, 降低了界面电阻, 更易于正极的容量发挥。使用Li-Zn-LiF参比电极的电池500次循环后的放电容量为98.6 mA∙ h/g, 而未处理锂金属参比电极的容量为61 mA∙ h/g, 容量保持率分别为70%和46%。此外, 在30 ~ 150圈循环区间, 两类电池均可观察到容量先行下降继而缓慢回升的现象, 以Li-Zn-LiF为参比电极的电池尤其明显。这一现象与正极表面状态的变化有关, 说明采用Li-Zn-LiF作为参比电极时, 更易检测到正极的变化。两类电池的结构相同, 其他材料也相同, 两种不同参比电极的测量结果产生如此大的差别, 可见是由于参比电极的稳定性不同引起的。因此, 用Li-Zn-LiF电极取代未处理锂金属作为参比电极, 可以显著提高电化学测量的准确性。
用含三氟甲烷磺酸锌和氟代碳酸乙烯酯的溶液处理锂金属表面, 可以形成一层界面保护膜, 显著提高锂金属参比电极的稳定性。锂金属首先与Zn(OTF)2发生置换反应, 置换出的锌单质与锂金属结合形成锌锂合金, 构成界面膜的内层, 赋予参比电极的锂金属溶解/沉积的可逆性; 随后, 锂金属再与FEC反应, 生成LiF, 构成界面膜的外层, 对锂金属起保护作用, 可抑制锂金属与电解液组分间的自发反应, 赋予参比电极良好的稳定性。因此, 采用处理后的锂金属电极作为参比电极进行电化学测量, 可以显著提高测量结果的准确性。这种处理方法简单且效果显著的参比电极制备方法, 对锂离子电池材料的研究具有重要的意义。通过优化处理溶液的组成, 还可进一步提高锂金属电极的稳定性。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|