作者简介:姚忠冉(1991-),男,博士,讲师,主要从事固态电解质及固态锂离子电池研究。
可充电锂离子电池(LIB)是移动和固定存储系统中最具潜力的电池体系。然而,传统锂离子电池中不稳定的电沉积和不可控的界面反应会在液体电解质中发生,导致电池存在安全隐患。采用固态电解质(SSE)的全固态锂离子电池因具有高安全性、高可靠性和高能量密度可满足许多方面对储能的要求。但要实现商业化,SSE依然面临诸多挑战,如室温离子电导率较低(1×10-5 ~ 1×10-3 S/cm)以及电极和电解质之间的界面稳定性差等。为加快SSE的研究与开发,分别对无机钙钛矿(LLTO)型、石榴石(LLZO)型和钠快离子导体(NASICON)型固态电解质的结构和电导率改性进行了综述,特别强调了电解质与电极界面的重要性及其对电池性能的影响。
Rechargeable lithium-ion battery (LIB) has become the most promising battery system of mobile and fixed storage systems. However, unstable electrodeposition and uncontrollable interfacial reactions in conventional LIB occur in liquid electrolytes, leading to potential safety hazards. Nowadays, the all-solid-state lithium-ion battery can meet the requirement of energy storage in many aspects due to its high safety, high reliability, and high energy density. Nonetheless, solid-state electrolyte (SSE) still faces many challenges, such as low ionic conductivity at room temperature (1×10-5-1×10-3 S/cm) and poor stability of the interface between the electrode and the electrolyte. To speed up the research and development, the structure and conductivity of the inorganic perovskite (LLTO), garnet (LLZO), and sodium super ionic conductor (NASICON) were reviewed in this paper. In addition, the importance of the interface between electrolyte and electrode were emphasized and their effects on the performance of the battery were illuminated.
随着化石燃料的不断耗竭以及人类对减少二氧化碳排放的强烈要求, 各国对开发可替代绿色(零排放)能源储存和转化技术的兴趣日益浓厚。目前最先进的可充电锂离子电池(lithium-ion battery, LIB)储能系统不需要燃料和氧化剂的持续供应, 不需要化学输入或输出, 并且锂离子电池具有优异的体积和质量能量密度, 被认为是最具潜力的能量储存技术[1, 2, 3, 4]。然而, 目前锂离子电池的大规模和商业化应用受到安全性问题的限制, 这些问题主要包括电极在充放电过程中的副反应以及液体电解质在电池充电过程中不
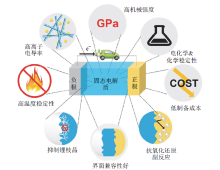
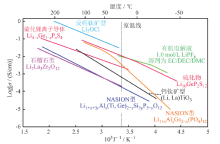
采用固态电解质的全固态锂离子电池因具有高安全性和高能量密度而引起研究人员的广泛关注, 是下一代电池体系的研究重点[9]。作为固态电池的关键材料, 固态电解质代替有机液体电解质, 不仅能抑制金属负极的枝晶生长和副反应的发生, 而且能消除有机液体电解质潜在的泄漏、汽化、可燃和锂离子电池的燃烧、爆炸等问题[10, 11]。应对电化学储能和转换系统的实际应用, 固态电解质的其他性能也很重要。图1为固态电解质的性能及结构要求[3]。由图可以看出, 与液体电解质所面临的挑战不同, 固态电解质的发展需要解决离子电导率、界面性能、机械强度和制造工艺等方面的问题, 才能将这种新型化学材料组成的固态电池体系推向市场[3, 6, 9]。图2和表1分别为不同类型固态电解质的离子电导率随温度变化曲线图和特性比较。从中可以看出, 氧化物无机电解质对空气和热稳定性高, 离子电导率较高, 原料成本低, 更易实现规模化制备[10, 11, 12, 13]。针对氧化物固态电解质, 减弱Li-O相互作用、实现锂离子的三维传输及优化传输通道中锂离子与空位浓度的比例均有利于提高锂离子的电导率。基于这些理念, 一些具有复杂结构的氧化物锂离子导体材料相继出现。本文主要综述具有钙钛矿(LLTO)型、石榴石(LLZO)型和钠快离子导体(sodium super ionic conductor, NASICON)型氧化物无机固态电解质的研究进展, 并对其在全固态锂电池中的应用进行展望。
目前, 无机盐固态电解质基本上分为氧化物类与硫化物类。硫化物是硬度较高的无机粉末, 与电极材料的空间电荷层, 造成界面相容性差, 电池电阻较大, 对电池倍率性能产生不利影响, 不适用于高电压锂离子电池[3, 14], 在此不作介绍。本文主要综述几种应用前景较好和新型的氧化物固态电解质体系。
钙钛矿结构可以用ABO3表示, 包含两个阳离子和多个氧缺陷, 其中A是一个较大的阳离子, 通常为稀土元素, 如Nd或La, 而B是一个较小的阳离子, 为过渡金属离子, 如Al或Ti等[15, 16]。已知的锂离子传导最快的固态电解质是钙钛矿型氧化物, 为镧钛酸锂La2/3-xLi3xTiO3(LLTO)体系[17]。图3a为La2/3-xLi3xTiO3(x = 0.11)的三维立体结构[18]。该类电解质的离子传输机理有两种:一种是二维传导机理, 即锂离子直接迁移到处于同一层的空隙上; 另一种是三维传导机理, 即跨层的协同迁移过程。镧对电导率起着非常关键的作用, 一方面高价La占据A位置并造成部分A位置空隙; 另一方面半径较大的La占据A位置有利于形成半径较大的空隙, 有利于Li+的迁移[9, 17]。
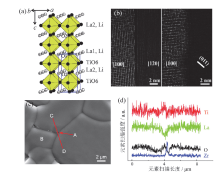 | 图3 (a)La2/3-xLi3xTiO3(x= 0.11)的三维立体结构[18]; (b)LLTO不同晶界类型的扫描透射电镜图[21]; (c)LLZO的掺入量为10%时, LLTO电解质的表面微观形貌[24]; (d)沿着(c)图中CD线上的元素分析Fig. 3 (a) Crystal structure of La2/3-xLi3xTiO3[18]; (b) STEM images of different grain boundary types for LLTO[21]; (c) the surface microstructure of LLTO electrolyte when the content of LLZO is 10%[24]; (d) elemental analysis along the CD line in (c) |
ROBERTSON等[19]报道了有关LLTO晶体导体的结构, 结果表明, 上述固溶体的稳定范围为0.04 < x < 0.14。另有研究表明, 将样品制备温度提高至1 350 ℃, 则稳定范围可扩展到0.03 < x < 0.167[20]。室温下LLTO电解质的离子电导率高达1× 10-3S/cm, 并且具有优异的电化学窗口(8 V, 相对Li/Li+电极), 但是LLTO电解质的晶界电阻较大, 这与其结构和化学不稳定性有关, 如从Ti4+到Ti3+的粒子还原、锂的耗尽以及Ti-O多面体的变形等因素的影响[15]。从图3b中可以看出, 锂离子在晶界处的输送缓慢, 导致离子电导率很低[21]。通过掺杂硅酸盐类添加剂(Al、Cr等)可明显提高LLTO电解质的离子电导率, 例如MORATA-ORRANTIA等[22]利用Al3+部分取代Ti4+, 成功制备La0.56Li0.33+xTi1-xAlxO3系列固态电解质, 离子电导率可达到2.95 × 10-3 S/cm。ABREU-SEPÚ LVEDA等[23]分别用传统固相合成和溶胶-凝胶法成功制备La(2/3)-xLi3xTi0.9Cr0.1O3体系固态电解质, 说明Li+更易以La[Li1/3(Ti, Cr)2/3]O3和Li1-xTi1+xO2的结构形式占据钙钛矿结构的B位(Ti位), 并且该体系展现出了较好的机械性能, 室温离子电导率也得到了一定的提高(1.2 × 10-4 S/cm)。CHEN等[24]提出了另一种提高电解质离子电导率的方案, 将Li0.35La0.55TiO3电解质与Li7La3Zr2O12(LLZO)电解质复合, 将LLZO溶胶加入其Li0.35La0.55TiO3前驱体粉末中, Zr离子主要掺杂于晶界处, Li0.35La0.55TiO3的晶界电导率会随着LLZO的引入而大幅度提高, 如图3c和图3d所示。室温条件下, 当Li0.35La0.55TiO3电解质中LLZO的质量分数为5%时, 总的离子电导率为1.2 × 10-4 S/cm, 其晶界导电率同样达到了1.5 × 10-4 S/cm。
此外, 提高LLTO体系的烧结温度, 增大晶粒尺寸, 同时保证Li源过量, 也被证明是一种提高电导率的有效方式[16, 25]。但是限制LLTO体系广泛应用的不仅仅是离子电导率的问题, 还有Ti4+与金属锂的稳定性问题。众多研究表明, LLTO体系的固态电解质在高电压下是稳定的, 但电压为1.5 V左右时, LLTO体系中的Ti4+便与负极金属锂发生还原反应, 生成Ti3+, 导致LLTO晶体结构的变化, 影响电池性能。解决这个问题的一个有效策略是在电解质表面沉积一层具有离子导电性的薄膜(如LiPON等), 通过物理方法阻断电解质与金属锂的直接接触来保护负极锂金属和电解质的化学稳定性。LI等[26]采用电子束蒸发法制备了无定形LLTO固态电解质薄膜, 采用LiPON薄膜作为镀层, 避免了LLTO与金属锂负极的不良反应, 然后组装了一种Li/LiPON/LLTO/LiCoO2型全固态电池体系, 其中, LiPON/LLTO作为固态电解质薄膜。该电池的放电容量约50 μ A∙ h/cm2, 也展现了较好的循环性能。
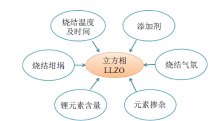
石榴石型固态电解质因具有较高的离子导电率和较宽的电化学窗口越来越受到人们的关注。无机石榴石型Li5La3M2O12(M = Ta和Nb)电解质体系于2003年被首次报道[27, 28], 室温下的锂离子电导率可达1× 10-6~ 1× 10-5 S/cm。研究表明, 含Ta石榴石Li5La3Ta2O12与金属锂的电化学稳定性较好, 其电化学窗口(6V, 相对Li/Li+ 电极)比含有Nb的LLZO型Li5La3Nb2O12更宽, 并且用Ba2+部分取代Li5La3Ta2O12中的La3+, 可以使离子电导率提高一个数量级, 同时降低活化能[28]。随着人们对固态电解质的不断研究, 另一种LLZO型的Li7La3Zr2O12体系被开发出来, 其对金属锂具有较高的化学稳定性, 并且还具有较高的离子电导率(2.44 × 10-4S/cm)和较低的活化能(0.31 eV)[29], 逐渐成为LLZO型固态电解质的研究重点[30, 31]。然而, LLZO固态电解质存在两种晶型:一种是在低温下具有I41/acd空间群的稳定四方相结构(离子电导率较低), 另一种是高温下具有Ia3d空间群的稳定立方相结构(离子电导率较高)。AWAKA等[32]采用湿化学法合成四方相Li7La3Zr2O12的LLZO型固态电解质, 并在室温下测得其体相锂离子电导率为1.63 × 10-6 S/cm, 晶界电导率低至5.59 × 10-7 S/cm。为提高四方相LLZO体系的离子电导率, 研究人员做了大量研究, 其中, WOLFENSTINE等[33]采用热压工艺成功制备出具有较高相对密度(约98%)的LLZO体系, 进而有效提高样品的离子电导率(约2.3 × 10-5 S/cm), 但其离子电导率仍难以满足应用要求(> 1× 10-3 S/cm)。因此, 针对LLZO电解质体系, 研究的主要问题是将其稳定在立方相阶段, 从而保证整个体系的室温电导率维持在较高水平(1× 10-4 ~ 1× 10-3 S/cm)。
JUNJI等[34]通过单晶X射线结构分析确定了立方Li7La3Zr2O12的详细晶体结构, 如图4a和图4b所示。从图中可以看出石榴石Li7La3Zr2O12的网状结构由十二面体的LaO8和八面体的ZrO6组成, Li1和Li2原子分别位于四面体24d位点和八面体96h位点, 锂离子可以通过三维通道从24d位点传导到96h位点。另外, Li2位点在理想的石榴石结构中是空的, 但是Li2位点处Li原子的无序和部分占据在锂离子传导过程中起着关键作用[35]。对此, 研究人员做了大量研究, 采取的措施主要有离子掺杂、添加烧结助剂和改善制备工艺等[36], 来稳定LLZO的立方相和提高其离子电导率, 如图5所示。
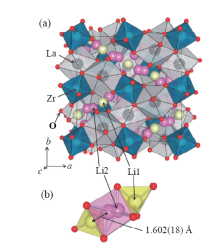 | 图4 (a)立方Li7La3Zr2O12晶体结构; (b)Li1和Li2位点周围的配位多面体[34]Fig. 4 (a) Crystal structure of cubic Li7La3Zr2O12; (b) coordination polyhedra around the Li1 and Li2 sites[34] |
DUMON等[37]通过添加质量分数为0.9% ~ 8.4%的SrCO3作为烧结助剂, 增大晶粒尺寸和离子导电率并有效稳定Li7La3Zr2O12立方相。当添加量为1.7%时, LLZO体系在室温下总的离子电导率约为5 × 10-4 S/cm, 活化能约为0.31 eV。此外, 石榴石型Li7La3Zr2O12固态电解质在Zr4+位点掺杂Ta4+、Nb5+和Y3+后, 离子电导率显著提高。OHTA等[38]采用Nb部分取代Zr, 合成Li7-xLa3Zr2-xNbxO12(x = 0 ~ 2)体系。室温下Li6.75La3Zr1.75Nb0.25O12(x = 0.25)显示出最高离子电导率(8 × 10-4 S/cm), 这是由于Nb5+掺杂使Li+位点周围的结构发生畸变和增加了Li+迁移率造成的[37]。SONG等[39]在Zr4+位点加入碱土金属元素Ca2+, 增强了LLZO的电导率, 降低烧结温度, 稳定石榴石立方相。掺杂的Ca2+成功进入LLZO中, 并在Zr4+位点形成八面体, 增大了晶格体积, 使得Li+ 随着晶格尺寸的增大而成功迁移。掺杂量为0.05时, Li7.1La3Zr1.95Ca0.05O12的室温离子电导率为5.2 × 10-4 S/cm, 活化能为0.27 eV, 且电化学稳定性可达9 V(相对Li/Li+电极)。
稳定立方相和提高离子电导率的方法很多, 也取得了长足的进展, 但LLZO体系固态电解质的主要挑战依然在于电解质与电极的界面相容性问题[40]。研究表明, 采用原子层沉积(atomic layer deposition, ALD)技术在LLZO与电极之间沉积一层Al2O3, 可有效缓解界面相容性问题, 原因在于界面处形成Li-Al-O层, 在一定程度上提高了电解质的润湿性, 降低了界面电阻, 提高了离子传输缓解了空间电荷层的影响[41]。如图6a ~ 图6c所示, 在金属锂和LLZO之间可成功添加Li-Al-O层, 进而有效缓解固/固界面之间的间隙, 并且界面阻抗得到明显降低。Al2O3修饰后锂电池展现了较好的循环稳定性, 电压没有不可逆增加或下降(图6c)。
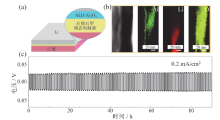 | 图6 (a)全电池的原理图; (b)ALD-Al2O3涂层与石榴石固态电解质截面元素扫描图; (c)Li/ALD-LLZO/Li对锂稳定性测试图[41]Fig. 6 (a) Schematic of the designed full cell using ALD-coated LLCZN; (b) typical TEM/HAADF image; (c) galvanostatic cycling of Li/ALD-treated LLZO/Li with a current density of 0.2 mA/cm2[41] |
其他亲锂修饰层也在此研究的基础上进行了探索, 如利用Si、Al、Ge或ZnO与熔融金属锂反应, 修饰石榴石与金属锂之间的界面, 形成锂合金, 从而改善界面相容性。另外, 为解决界面接触问题, OHTA等[42]采用锂离子导体Li3BO3(LBO)作为全固态锂电池中LiCoO2正极材料与Li6.75La3Zr1.75Nb0.25O12(LLZONb)电解质之间的缓冲层。通过退火工艺将LBO烧结到正极中, 从而实现正极与LLZONb固态电解质之间充分的界面接触, 所得电池具有良好的电化学性能和较低的界面电阻。
钠快离子导体(sodium super ionic conductor, NASICON)是由XIE等[43]最早提出, 他们发现将NaZr2(PO4)3中的部分P用Si替换后可以得到Na超离子导体(Nal+xZr2SixP3-xO12), 并将类似结构化合物命名为NASICON, 其公式为AM2(PO4)3, 其中一个A位点被碱金属离子(如Li+、Na+)占据, M位点被Ti、Ge、Zr占据, 即用Li取代Na, 同样得到具有较高离子电导率的锂离子导体。具体来说, NASICON材料形成三维网络结构, 沿c轴方向通过MO6八面体和PO4四面体共顶点形成稳定的骨架结构和三维钠离子传输通道。结构中的锂离子在驱动力的作用下沿着三维钠离子传输通道发生迁移, 表现为宏观上的锂离子传输[9, 44]。因此, NASICON材料的离子电导率取决于锂离子的浓度和NASICON骨架的组成。如表2所示, 与LLTO和LLZO型电解质相比, NASICON型固态电解质以其较高的离子电导率、化学稳定性(可在空气中完成制备和组装)以及原料成本低等优点, 而成为一种有前景的锂电池固态电解质体系[45]。
| 表2 不同氧化物固态电解质的优缺点比较 Table 2 Comparison of various oxide solid-state electrolytes |
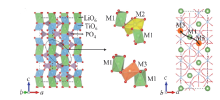
图7为LiTi2(PO4)3(LTP)固态电解质晶体结构图(典型的NASICON型电解质), 对其研究表明, LTP晶粒的离子电导率约为1× 10-4 S/cm, 但LTP在室温下总离子电导率很低(1× 10-8~ 1× 10-6S/cm), 这主要是由于在晶界处存在相对密度较低的杂相造成的[10, 46]。AONO等[45]指出, 固态电解质的离子导电率随样品振实密度的增加而增加, 特别是三价原子掺杂对LTP晶体的结构修饰可以得到高密度的陶瓷。其中, Al3+掺杂不仅可以提高Ti-O键的强度, 而且可以降低微观结构中的Li-O键, 从而提高离子导电性[46]。对于Li1+xAlxTi2-x(PO4)3(LATP)体系, 当Al3+掺杂量为0.3时, Li1.3Al0.3Ti1.7(PO4)3(x = 0.3)固态电解质具有最高的离子电导率[47, 48, 49]。本课题组采用共沉淀法制备出综合性能优异的LATP陶瓷电解质, 室温电导率可达2.19 × 10-4 S/cm[50]。MA等[51]分别采用传统固相合成和溶胶-凝胶法制备出纯相的Li1.3Al0.3Ti1.7(PO4)3固态电解质, 并对其微观结构和电化学性能进行了测试, 发现在800℃下烧结12 h得到的样品的离子电导率可达到1.21 × 10-3 S/cm, 并且具有较低的活化能(0.26 eV)。HE等[52]报道了一种新的合成LATP体系的方法。首先, 水热合成菱形Al-NH4TiOPO4+Li3PO4前驱体, 然后通过退火处理, 得到LATP相。研究结果表明, 室温下样品的相对密度达到97.3%, 离子电导率为0.48 mS/cm, 同时具有较低的活化能(0.30 eV)和电子电导率(约为1× 10-6mS/cm)。该方法不仅丰富了LATP体系固态电解质的合成工艺, 更促进了陶瓷基固态电解质的发展。
高度结晶和致密的Li1+xAlxTi2-x(PO4)3(LATP)固态电解质具有较高的离子导电率(1× 10-3S/cm), 并且在不同电荷状态下与正极材料具有良好的化学相容性, 但是其与含Ti4+钙钛矿电解质存在同样的本征缺陷(与LLTO电解质存在同样的问题, 如表2所示)。如与锂金属的接触将立即触发Ti4+还原为Ti3+的严重副反应, 降低了电解质的晶界离子导电率, 从而阻碍了LATP系列电解质的实际应用。为了改善NASICON型电解质对锂金属的界面不稳定性, 研究人员提出了以Ge4+取代高活性Ti4+的方法。结果表明, Li1+xAlxGe2-x(PO4)3(LAGP)体系固态电解质因具有较高的离子导电率(1× 10-3 S/cm), 电化学窗口宽(~ 6 V), 适用温度范围宽, 并且对在空气中O2和H2O具有较好的抵抗力, 以及优越的机械强度, 从而防止锂枝晶的穿透[53]。然而, 如式(1)、式(2)所示, 当LAGP与锂金属负极直接接触时, 电解质表面Ge4+也会发生一定的还原反应, 在LAGP/Li界面上出现以电子输运为主的界面相, 这不利于Li+ 在晶界的扩散过程[54, 55, 56]。
GeO2+4Li↔ Ge + 2Li2O, ∆ G ≈ -150 kJ/mol(Li)(1)
GeO2+2Li↔ GeO+ Li2O, ∆ G ≈ -112 kJ/mol(Li)(2)
因此, 界面问题依然是限制NASICON型固态电解质发展的重要因素。LIU等[54]在LAGP和金属锂接触界面处喷涂一层60 nm左右的锗(Ge)金属层(如图8a所示), 从而有效缓解Ge4+元素还原为Ge2+或Ge0的副反应。电池在充放电过程中, 金属Ge层与金属锂发生合金反应, 生成Ge-Li合金, 组装得到的Li/Ge/LAGP/RuO2@CNT型固态Li-O2电池也展现出了较好的循环性能(如图8b), 说明Ge-Li具有优异的锂离子电导率和化学稳定性。
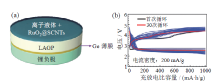 | 图8 (a)Li/Ge/LAGP/RuO2@CNT电池结构组成图; (b)固态Li/Ge/LAGP/RuO2@CNT型Li-O2电池循环性能图[54]Fig. 8 (a) Schematic diagram of Li/Ge/LAGP/RuO2@CNT battery; (b) cycle performance of Li/Ge/LAGP/RuO2@CNT Li-O2 battery[54] |
WANG等[57]采用磁控溅射的方式在金属锂表面沉积一层500 nm左右的LiPON层, 以LAGP-PEO为复合电解质, LiFePO4为正极活性物质, 成功组装为Li(LiPON)/LAGP-PEO(LiTFSI)/LiFePO4全固态电池。其中, LiPON膜在界面上提供均匀的Li+通量, 有效抑制全固态电池中锂枝晶的形成; PEO及其衍生物络合锂盐类聚合物电解质在较高的温度下也有较高的离子电导率, 且加工性能好, 与LAGP电解质无机粒子进行复合后, 能够减少聚合物电解质的界面极化, 增加固态电解质与正负极间的界面相容性。两步改性相结合得到的全固态电池展现了优异的电化学性能, 初始放电容量为152.4 mA∙ h/g, 并具有良好的循环稳定性和倍率性能, 如图9所示。针对固态电解质与电极之间不同类型的接触界面, 研究人员也对此做了大量研究, 总体思路依然是通过材料结构的设计和界面的修饰来解决空间电荷层和界面兼容性等问题, 进而改善离子传导性和电池的性能。
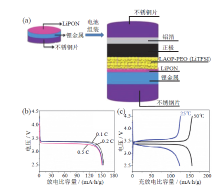 | 图9 (a)Li(LiPON)/LAGP-PEO(LiTFSI)/LiFePO4固态锂电池制备机理图; (b)电池倍率性能图(截止电压为2.5 ~ 4.5 V, 50℃); (c)电池在不同温度下的充放电曲线图(0.1 C)[57]Fig. 9 (a) Schematics of the preparation of the all-solid-state Li metal battery; (b) rate performance of Li(LiPON5)/LAGP-PEO(LiTFSI)/LiFePO4 cells (cutoff voltage of 2.5-4.5 V, 50oC); (c) charge-discharge curves of cells at different temperatures[57] |
为解决传统液态锂离子电池电解液的泄漏、锂枝晶的生长等问题, 全固态锂电池的研发和应用引起了研究人员的广泛关注。作为全固态锂电池的一个关键组成部分, 固态电解质的合理应用是由高离子电导率、良好的力学性能以及与电极材料的相容性等一系列要求决定的。即对于固态电池的整体发展而言, 电解质/电极界面的稳定性依然是锂离子传输所面临的重要挑战。因此, 针对固态电池未来的研究, 应当继续以提升材料离子导电率和改善界面稳定性为基础, 优化电池的设计和运行, 利用先进的表征技术和理论分析手段, 进一步了解固态电解质在不同电池体系中的微观反应, 从而有针对性地设计出高性能的固态电解质体系, 用于高安全性和高能量密度的锂电池。一方面为了改善负极/电解质界面性能, 在固-固界面之间设计界面层是一种有效方法, 即将固态电解质和锂金属电极之间的刚性接触改变为软接触, 不仅可以降低锂金属/固态电解质的界面阻抗, 有利于锂离子在相界面的快速转移, 还有利于锂的均匀沉积, 抑制锂枝晶的生长。另一方面, 为解决正极/固态电解质界面存在的问题, 通过加热、浇铸或原位聚合使固态电解质组分渗透到正极活性材料中, 设计多孔固态电解质作为负载正极材料的主体, 实现与固液接触相当的无缝原子级电极/电解质界面是新的研究方向。基于以上分析可知, 固态电解质通过改性能够显著提升离子电导率, 结合界面改性技术能够实现固态电池性能提升。未来随着电解质技术、界面技术和锂金属负极保护技术的成熟, 半固态电池(固态电池中添加电解液)和液态电池将会逐渐被含锂负极的全固态电池所替代。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|