作者简介:吕珍珍(1997-),女,硕士研究生,主要从事利用ZIF-8固定化米曲霉脂肪酶(AOL)的制备及其应用研究。罗 文(1981-),女,博士,副研究员,硕士生导师,主要从事生物柴油生产关键技术、脂肪酶分子改造以及呋喃醛高值化转化研究。
生物柴油是一种绿色环保的生物液体燃料。提升酶法生产生物柴油的效率,寻找高效的脂肪酶固定化策略至关重要。金属有机框架具有孔隙率高、孔隙可调性好、易于功能化和修饰等独特的性能,是一种多孔结构的优良载体材料。以金属有机框架材料ZIF-8为载体,采用共沉淀法对米曲霉脂肪酶(AOL)进行原位包埋固定,制备纳米花结构的AOL@ZIF-8固定化酶。以该固定化酶AOL@ZIF-8、游离酶AOL及商业固定化酶Novozym 435作为催化剂,以大豆油为原料制备生物柴油,优化了生产工艺并比较了各催化剂的效果。在最优条件下,AOL@ZIF-8催化的生物柴油产率达到94.08%,其活性与重复使用性显著优于游离酶,与商业固定化酶Novozym 435接近。
Biodiesel is a sustainable and environmentally friendly bio-liquid fuel, and finding an efficient method for lipase immobilization to produce biodiesel enzymatically is a priority. Metal-organic frameworks, known for their high porosity, adjustable pore size, ease of functionalization, and modification, are excellent porous carrier materials. In this study, the metal-organic framework ZIF-8 was used as a carrier to immobilize lipase from Aspergillus oryzae (AOL) via co-precipitation, resulting in the formation of AOL@ZIF-8 with a nanoflower structure. Biodiesel was synthesized using soybean oil as raw material with AOL@ZIF-8, free AOL enzyme, and commercial immobilized enzyme Novozym 435 as catalysts. The production process was optimized, and the catalytic effects were subsequently compared. Under optimal conditions, the yield of biodiesel catalyzed by AOL@ZIF-8 reached 94.08%. Its activity and reusability were significantly better than the free enzyme and comparable to the commercial immobilized enzyme Novozym 435.
脂肪酶(三酰甘油酰基水解酶, EC 3.1.1.3)是生物技术领域中比较重要的生物催化剂[1], 具有选择性高[2]、催化效率高、多功能性等突出优势[3, 4], 是食品、化学和制药工业中的核心催化剂[5, 6]。然而稳定性差、难回收等问题限制了游离脂肪酶在工业上的大规模应用[7], 固定化脂肪酶是解决这些问题的有效策略之一。固定化可以提高脂肪酶的重复使用性[8], 显著降低酶使用成本, 并可以改善和提高酶的特性, 如特异性、活性和动力学参数等[7]。
金属有机框架(metal-organic frameworks, MOFs)是一类新型多孔材料[9], 由有机配体与金属节点之间的配位键结合而成[10]。MOFs材料具有晶体结构多样、孔径大小可控、孔隙率高、比表面积大等特点, 受到人们的广泛关注[11, 12]。其中, 沸石咪唑框架(zeolitic imidazolate framework, ZIF)系列可以在常温下合成、稳定性极佳而且细胞毒性可忽略不计, 可用于固定化酶[13]。最具代表性的是ZIF-8, 其由金属离子Zn2+和有机配体2-甲基咪唑环上的N原子配位形成[14]。ZIF-8具有优异的稳定性, 可实现长期运行, 而且其具有多孔结构、易于改性、毒性较低、生物相容性好等优势以及在常温以水为溶剂的条件下即可合成。因此, ZIF-8已被用作固定酶的载体, 并在催化应用中取得了卓越的效果[15]。
生物柴油因其缓解环境污染和能源危机的潜力引起了人们的极大兴趣[16, 17]。在过去的十年中, 生物柴油在全球范围内的工业生产和消费取得了显著增长[18]。生物柴油被定义为长链脂肪酸单烷基酯(fatty acid monoalkyl ester, FAME)的混合物, 其来源于可再生油脂, 如植物油或动物脂肪[19]。脂肪酶因其独特的生化特性, 在酯交换制备生物柴油反应中表现出较高的催化活性与专一性, 大幅降低了醇的用量, 并且反应条件温和, 对环境友好, 是制备生物柴油的良好催化剂[20, 21, 22]。
本文以ZIF-8为载体, 采用共沉淀法原位包埋固定米曲霉脂肪酶(命名为AOL@ZIF-8)。探究原料浓度对脂肪酶酶活力的影响, 并对固定化酶的结构进行表征。通过与游离酶及商业固定化酶对比, 研究AOL@ZIF-8固定化酶催化大豆油制备生物柴油的性能, 并优化生产工艺。
米曲霉脂肪酶(lipase from Aspergillus oryzae, AOL)和Novozym 435购自上海源叶生物科技有限公司, 2-甲基咪唑和二水合乙酸锌(分析纯)购自上海麦克林生化科技股份有限公司, 棕榈酸对硝基苯酯(p-nitrophenyl-palmitate, p-NPP)购自西格玛奥德里奇贸易有限公司(上海), 大豆油购自金龙鱼食品集团有限公司。其他试剂均为分析纯。
1.2.1 AOL@ZIF-8的制备
AOL@ZIF-8通过参考文献[13]的方法, 稍做调整而合成。配制40 mmol/L的乙酸锌溶液, 缓慢加入5 mL AOL酶液, 静置15 min。配制800 mmol/L的2-甲基咪唑溶液, 用乙酸将pH调至8.0, 再缓慢加入乙酸锌和酶的混合液中, 以300 r/min转速搅拌60 min。所得产物以10 000 r/min离心10 min, 用去离子水清洗3次, -48 ℃冷冻干燥, 得到固定化酶AOL@ZIF-8。
1.2.2 Zn2+和2-甲基咪唑对酶活力的影响
配制不同浓度的乙酸锌和2-甲基咪唑溶液, 将游离脂肪酶分别置于上述溶液中静置孵育30 min, 然后测试酶活力。
1.2.3 脂肪酶浓度测定
脂肪酶的浓度测定参考Bradford法[23]并稍做改动。配制一系列不同浓度的标准蛋白溶液, 在酶标仪中测定其在595 nm处的吸光度, 每个样品测三次, 取其平均值。以标准蛋白质溶液浓度为横坐标, 595 nm处吸光度值为纵坐标, 绘制蛋白质浓度的标准曲线。
1.2.4 脂肪酶活力测定
采用p-NPP法进行酶活力测定。总反应体系是1 mL, 将脂肪酶与50 mmol/L磷酸缓冲液混合, 在40 ℃水浴中保温孵育5 min。取20 μ L对硝基苯基棕榈酸酯异丙醇溶液, 加入反应体系中混匀开始计时, 5 min后, 加入200 μ L过氧化氢溶液终止反应。测定显色后离心的上清待测反应液在410 nm处的吸光度。一个脂肪酶催化活性单位定义为在测定条件下每分钟释放1 μ mol对硝基苯酚的量。每个样品做三组平行样品。
1.2.5 固定化酶的储存稳定性
称取一定质量的固定化脂肪酶AOL@ZIF-8 和游离AOL, 将其分别放置于冰箱冷藏室4 ℃保存, 间隔不同的时间(0~60 d)取一定质量的酶与p-NPP底物溶液反应5 min, 测定酶活力。以存放前的活力为100%, 计算不同贮藏时间后的相对活力。
1.2.6 脂肪酶催化剂制备生物柴油
称取5 g大豆油和适量甲醇(甲醇与油的摩尔比为3:1, 油的分子量以768 g/mol计算), 置于15 mL耐压瓶中, 再加入0.1 g AOL@ZIF-8(或相同质量的游离AOL和商业固定化酶Novozym 435)。在45 ℃和转速为300 r/min下反应24 h。反应结束后, 以10 000 r/min离心5 min, 得到分层的样品, 按照体积比1:1加入去离子水, 水洗去除产物中残留的甲醇。再次离心分层取上层样品, 加入少许无水氯化钙, 震荡摇匀去除生物柴油样品中的水分。再次离心, 取上层样品即为制备得到的生物柴油。
以此工艺参数为基础, 后续改变相关参数进行单因素实验, 优化生物柴油制备工艺。
1.2.7 AOL@ZIF-8重复使用性能
取一定质量的AOL@ZIF-8用于催化大豆油与甲醇反应制备生物柴油。将离心所得AOL@ZIF-8用磷酸盐缓冲液(pH = 8.0)清洗3次, 将洗涤后的AOL@ZIF-8重新加入新鲜的反应混合物中, 进行下一轮的生物柴油制备。每轮催化反应进行24 h, FAME产率通过气相色谱进行分析。
1.2.8 催化剂结构表征方法
采用扫描电子显微镜(scanning electron microscope, SEM)(日本, Hitachi, S-4800)观察样品的微观结构和形貌, 加速电压设置为20 kV, 放大倍数为20~50万倍。采用快速升温热重系统对样品进行热重分析(thermo gravimetric analyzer, TGA)(美国, Waters, SDT650), 气体氛围为10 mL/min的氮气气氛, 以10 ℃/min的速率由室温升至1 000 ℃。
1.2.9 生物柴油产物分析方法
采用气相色谱法对生物柴油中的FAME含量进行测试。称取20 mg生物柴油样品, 加入正己烷, 定容至5 mL, 然后混匀。溶液经0.25 μ m针式过滤器过滤, 通过气相色谱仪(日本, Shimadzu, GC-2010Plus)测定, 进行分析。色谱检测条件如下:进样口温度250 ℃, 进样量1.0 μ L, 分流比30:1; FID检测器温度300 ℃; 载气为氩气, 流速30 mL/min; 升温程序为初温100 ℃, 以28 ℃/min升至185 ℃, 然后以20 ℃/min 升至225 ℃, 再以5 ℃/min升至240 ℃, 保持3 min。
生物柴油产率定义为FAME与原油的质量比, 用质量百分比表示, 根据下式计算:
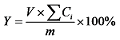 |
式中:Y为生物柴油产率, %; m为待测产品的质量, g; Ci为各脂肪酸甲酯的浓度, g/cm3; V为容量瓶的恒定体积, cm3。
酶作为一种生物蛋白催化剂, 相比于传统的化学催化剂, 对反应条件比较敏感, 易受外界因素的干扰。其中温度、pH、重金属和有机化合物等都可能对酶的催化活性产生影响[24]。本固定化体系中含有金属离子Zn2+和有机配体2-甲基咪唑的混合溶液, 可能会影响酶的活性。因此, 考察了金属离子和有机配体对AOL的影响。
如图1(a)所示, 相比于直接在水中孵育的脂肪酶, 在乙酸锌溶液中孵育后, AOL酶活力先是随着Zn2+浓度增加而升高, 然后随着Zn2+浓度进一步升高而有所下降。当Zn2+浓度为40 mmol/L时, 酶活力提高幅度最大, 是其在水溶液中的1.6倍左右, 这是由于Zn2+对部分脂肪酶起到稳定和激活作用[25], 而且Zn2+有助于维持蛋白质三级结构中二级元素的灵活性, 促进特定氢键相互作用和重排, 从而促进脂肪酶更稳定的活性状态。因此, 选择40 mmol/L Zn2+溶液为固定化过程的最佳浓度, 制备的AOL@ZIF-8酶活力回收率高达95%。
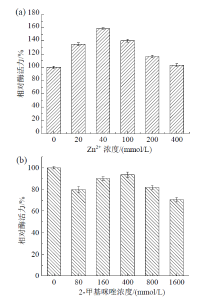 | 图1 Zn2+浓度(a)和2-甲基咪唑浓度(b)对AOL酶活力的影响Fig. 1 Effect of Zn2+ concentration (a) and 2-methylimidazole concentration (b) on the enzyme activity of AOL |
2-甲基咪唑浓度对酶活力的影响则相反, 如图1(b), 相比于水溶液, 在2-甲基咪唑溶液中孵育30 min后的AOL酶活力有一定程度的下降, 这是由于2-甲基咪唑溶液呈碱性, 碱性环境会在一定程度对脂肪酶酶活力产生不利影响。经实验测定, 400 mmol/L 2-甲基咪唑溶液的pH接近11, 而强酸[26]或强碱[27]溶液有很大可能会导致酶失活, 尤其是脂肪酶[28]。因此, 制备过程采用乙酸调节体系pH至8。
利用场发射扫描电镜观察不同乙酸锌与2-甲基咪唑比例条件下AOL@ZIF-8的形貌结构。结果发现乙酸锌和2-甲基咪唑质量比为1:20的条件下制备得到的AOL@ZIF-8呈层状纳米花结构, 具有较大的比表面积[29], 如图2(a)所示, 在催化反应时能和底物充分接触, 具有较高的催化活性。通过热重分析考察AOL@ZIF-8中酶的比例。如图2(b)所示, 在120~190 ℃之间观察到AOL@ZIF-8的第一分解阶段。在该阶段观察到大约24%的重量损失, 这对应于客体分子如H2O和有机小分子的损失[30]。下一个分解阶段从300 ℃开始, 在600 ℃左右结束, 占重量损失的45%, 对应酶的分解过程。此外, X射线衍射(X-ray diffraction, XRD)结果表明ZIF-8和AOL@ZIF-8具有相似的光谱结构, 且与相关文献合成的有机金属框架材料ZIF-8的XRD衍射峰一致[31]。
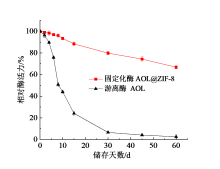
酶的储存稳定性是其商业化应用的重要指标, 游离酶和固定化酶的储存稳定性如图3所示。
图3中, 随着储存时间的延长, 游离酶和固定化酶的活性均有一定程度下降。AOL@ZIF-8在存放10 d后酶活力才出现明显下降, 存放两个月之后, 酶活力仍能保持在60%。而游离酶活性下降比较迅速, 10 d时酶活力仅约为40%, 两个月后几乎失去全部活性。此外AOL@ZIF-8的酶活力下降曲线趋势比游离酶明显更为平稳, 可见AOL固定在金属有机框架ZIF-8载体上后, 其储存稳定性得到显著提高。
2.4.1 油醇摩尔比的影响
在大豆油的醇解过程中, 高浓度的醇可帮助反应平衡向右移动, 但过量的醇也会导致脂肪酶失活。如图4所示, 随着油醇摩尔比的增大, 生物柴油的产量先升高再降低。当油醇比为1:4时, 反应24 h后AOL@ZIF-8催化的生物柴油产率最高为90.26%, 而此时游离酶AOL催化的生物柴油产率仅为73.95%。
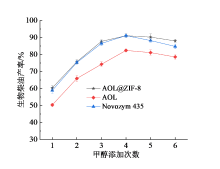
2.4.2 甲醇添加方式
醇的添加方式对酶催化制备生物柴油有很大影响。如图5所示, 当甲醇分四次等量添加到反应体系时, 生物柴油产率均最高。AOL@ZIF-8、游离酶AOL和商业固定化酶Novozym 435催化得到的生物柴油产率分别为91.05%、82.39%和91.09%。
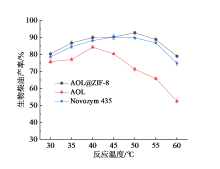
2.4.3 反应温度
如图6所示, 当温度为50 ℃时, AOL@ZIF-8催化的生物柴油产率最高, 为92.74%。而游离酶AOL在温度为40 ℃时得到的生物柴油产率最高仅为84.29%, 由此可表明经固定化后AOL的温度耐受性也显著提高。同时反应时间对生产成本影响较大, 也是比较重要的影响因素。
2.4.4 反应时间
由图7可知, 随着反应时间的延长, 生物柴油产率整体都是先升高后趋于一个相对稳定的趋势。当反应时间为24 h时, AOL@ZIF-8催化的生物柴油产率可达到93.03%, 此时反应逐渐趋于平衡, 继续延长反应时间会降低生产效率并增加成本。
2.4.5 酶添加量
酶添加量对生物柴油产率的影响如图8所示。图中可见, 随着酶添加量增加, 生物柴油产率整体都是先升高后略微下降的趋势。酶含量的增加使其与大豆油的接触更为充分, 反应速率加快。生物柴油产率随酶量的增加呈现先升高后趋于平衡, 甚至有降低的趋势。在酶添加量为大豆油质量的4%时, AOL@ZIF-8催化制备生物柴油产率最高达93.59%。而游离AOL在添加量为大豆油的5%时才达到最高生物柴油产率为86.75%, AOL@ZIF-8的酶用量少于游离AOL, 得到的生物柴油产率仍较高, 这也表明固定化提高了AOL的催化活性和经济效益。
2.4.6 加水量
含水量是影响生物柴油产率的一个重要参数。酶分子表面有一层“ 必须水” 对维持酶分子的最适构型有着重要作用[28], 在酯交换过程中, 也会影响反应平衡[32], 过多的水在体系中会发生如水解等副反应[33]。如图9所示, 随着含水量的增加, 生物柴油产率也是整体呈现先升高后下降的趋势。在加水量为大豆油质量分数的4%时, AOL@ZIF-8催化生物柴油产率最高为94.08%。在整个优化过程中, AOL@ZIF-8催化生物柴油的表现都与商业固定化酶Novozym 435表现相似, 甚至略优于商业固定化酶。这种使用AOL@ZIF-8催化制备生物柴油的成功尝试, 显示了其在实际应用中的巨大潜力。
采用共沉淀法将米曲霉脂肪酶原位包埋固定在金属有机框架材料ZIF-8上, 由于Zn2+对酶具有激活作用, 固定化酶AOL@ZIF-8酶活力回收率高达95%。AOL@ZIF-8呈层状纳米花结构, 具有较大的比表面积和较高储存稳定性。以AOL@ZIF-8为催化剂、大豆油为原料, 制备生物柴油。当油醇摩尔比为1:4、甲醇分四次等量加入反应体系、反应温度为50 ℃、反应时间为24 h、加酶量和加水量都为大豆油质量的4%时, 利用AOL@ZIF-8催化的生物柴油产率可达到94.08%, 重复利用催化制备生物柴油10次时, 产率仍能达到75%左右。AOL@ZIF-8固定化酶的活性及重复使用性与商业固定化酶Novozym 435相当, 具有较好的应用潜力。
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|