0 引言
1 催化分解反应动力学实验
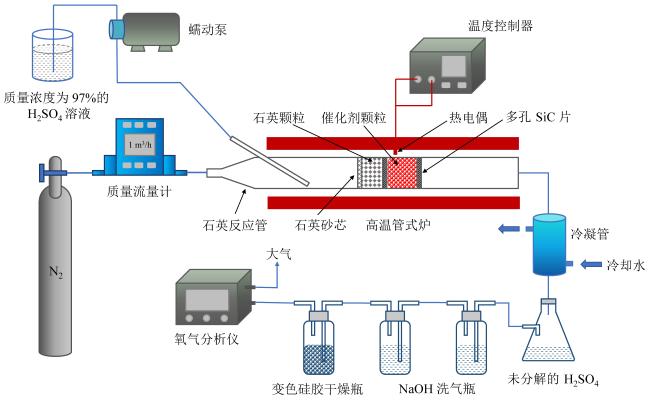
1.1 实验系统
Fig. 1 Experimental system of SO3 catalytic decomposition reaction kinetics research图1 SO3催化分解反应动力学研究实验系统 |
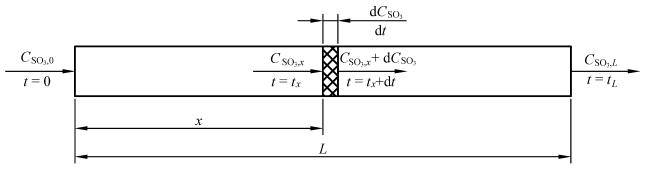
1.2 实验原理
Fig. 2 Analytical model of SO3 catalytic decomposition reaction kinetics图2 SO3催化分解反应动力学分析模型 |
2 数值仿真模型
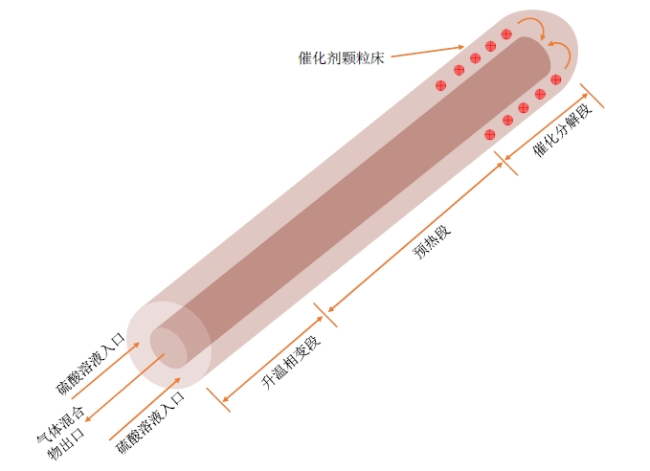
2.1 几何模型
Fig. 3 Schematic diagram of bayonet sulfuric acid decomposer图3 刺刀式硫酸分解器示意图 |
Table 1 Dimensions of the sulfuric acid decomposers表1 硫酸分解器的尺寸 |
| 结构形式 | 外管外径(壁厚)/mm | 内管外径(壁厚)/mm | 预热段是否填充SiC球 |
|---|---|---|---|
| 结构一 | 106(3) | 50(2) | 否 |
| 结构二 | 106(3) | 72(2) | 否 |
| 结构三 | 106(3) | 72(2) | 是 |
2.2 数学模型和网格划分
Fig. 4 Schematic diagram of the grid图4 网格示意图 |
2.3 物性参数和边界条件
Table 2 Computational conditions表2 计算条件 |
| 参数 | 取值 |
|---|---|
| SiC导热系数/(W∙m-1∙K-1) | 46 |
| Fe2O3导热系数/(W∙m-1∙K-1) | 4 |
| 入口气体混合物流量/(kg∙h-1) | 12.152 8 |
| 入口气体混合物温度/K | 623.15 |
| 入口硫酸蒸气质量分数 | 0.6 |
| 入口水蒸气质量分数 | 0.4 |
| 外壁面加热温度/K | 1 173.15 |
| 压力/MPa | 0.1 |
3 结果和讨论
3.1 催化分解反应动力学参数分析
Table 3 Kinetic experimental conditions of SO3 decomposition reaction catalyzed by Fe2O3表3 Fe2O3催化SO3分解反应动力学实验条件 |
| 序号 | 泵转速/ (r/min) | 硫酸流量/ (g/min) | GWHSV/h-1 | 反应温度/K |
|---|---|---|---|---|
| 1 | 1.0 | 4.862 30 | 16.125 | 1 023 ~ 1 123 |
| 2 | 0.8 | 3.889 84 | 13.002 | 1 023 ~ 1 123 |
| 3 | 0.7 | 3.403 61 | 11.301 | 1 023 ~ 1 123 |
注:GWHSV为重时空速比,表示硫酸溶液的质量流量与催化剂的质量之比。 |
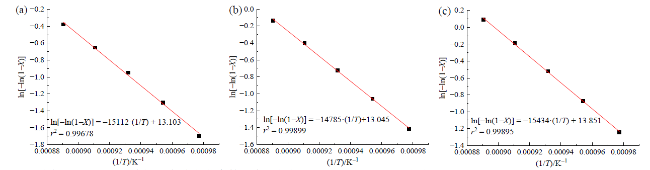
Fig. 5 Determination of kinetic parameters of SO3 decomposition reaction at different GWHSV: (a) GWHSV = 16.125 h-1; (b) GWHSV = 13.002 h-1; (c) GWHSV = 11.301 h-1图5 不同GWHSV下SO3分解反应动力学参数测定:(a)GWHSV = 16.125 h-1;(b)GWHSV = 13.002 h-1;(c)GWHSV = 11.301 h-1 |
Table 4 Kinetic parameters of SO3 decomposition reaction catalyzed by Fe2O3表4 Fe2O3催化SO3分解反应动力学参数 |
| 序号 | GWHSV/h-1 | A/s-1 | Ea/(kJ/mol) |
|---|---|---|---|
| 1 | 16.125 | 1.238 × 107 | 125.64 |
| 2 | 13.002 | 1.007 × 107 | 122.92 |
| 3 | 11.301 | 2.073 × 107 | 128.32 |
| 平均值 | — | 1.439 × 107 | 125.63 |
3.2 三种结构形式的对比分析
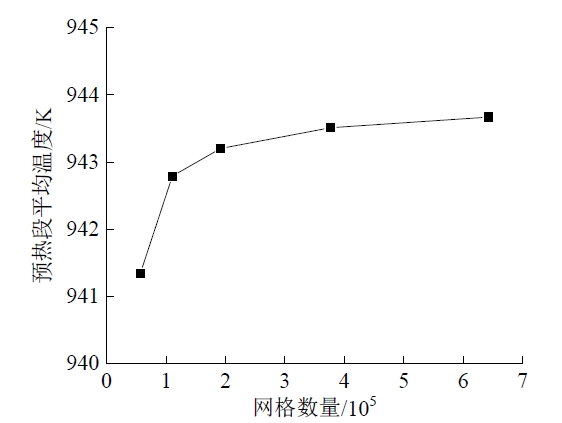
Fig. 6 Verification of the grid independence图6 网格无关性验证 |
Table 5 Length dimensions of the sulfuric acid decomposers表5 硫酸分解器的长度尺寸 |
| 结构形式 | 预热段长度/mm | 催化分解段长度/mm |
|---|---|---|
| 结构一 | 5 200 | 250 |
| 结构二 | 2 950 | 300 |
| 结构三 | 870 | 300 |
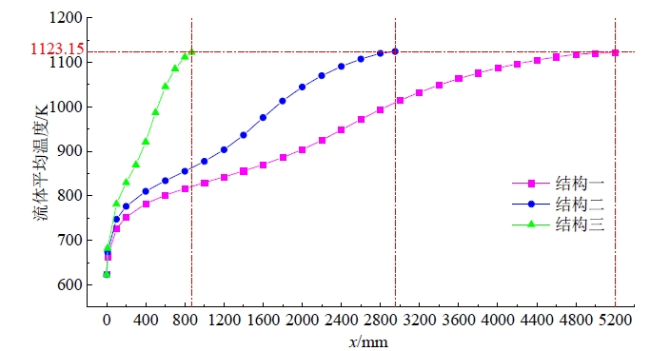
Fig. 7 Average fluid temperature change at each position of the preheating section图7 预热段各位置处的流体平均温度变化 |
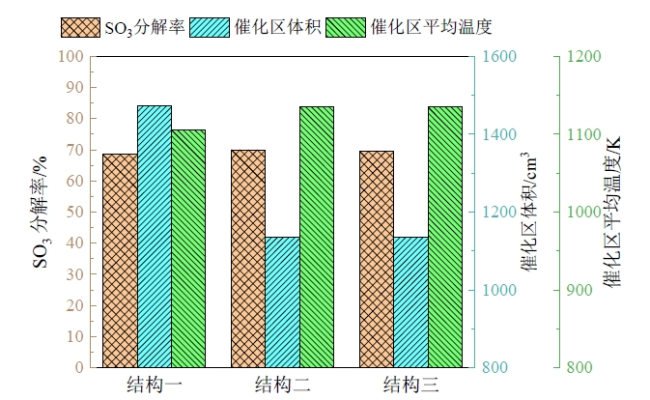
Fig. 8 SO3 catalytic decomposition rate, average fluid temperature in the catalytic section and volume of the catalytic section图8 SO3催化分解率、催化区流体平均温度和催化区体积 |
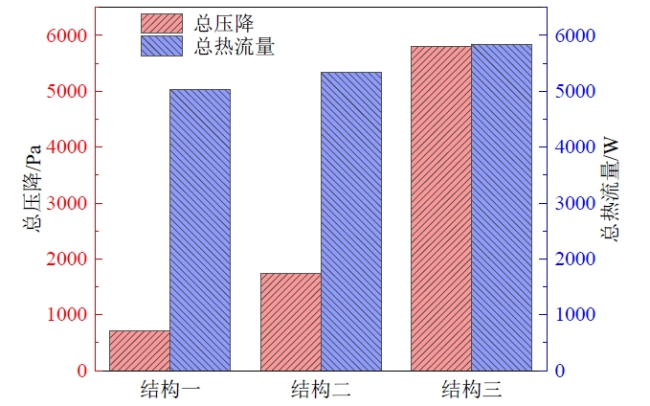
Fig. 9 Total heat flux and pressure drop in the decomposer图9 分解器内的总热流量和总压降 |
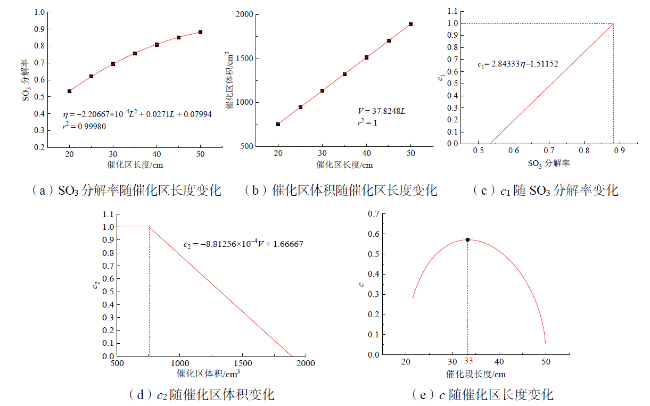
3.3 不同催化区长度的影响
Fig. 10 Analysis of optimal catalytic length图10 最佳催化区长度分析 |
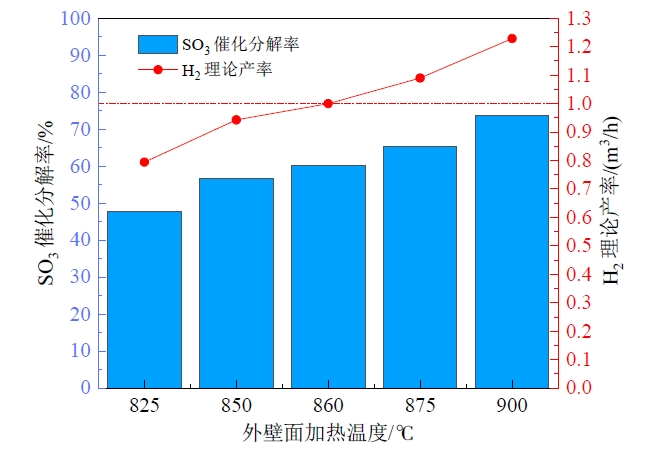
3.4 不同外壁面温度的影响
Fig. 11 Effect of outer wall temperature on SO3 catalytic decomposition rate and theoretical H2 yield图11 外壁面温度对SO3催化分解率和理论H2产率的影响 |