0 引言
Table 1 Comparison of synthesis time of LiNi1-xMnxO2 (1-x ≥ 0.6) by different methods表1 不同方法合成LiNi1-xMnxO2(1-x ≥ 0.6)耗时比较 |
| 制备方法 | 正极材料 | 反应温度和时间 | 后处理过程 | 总耗时 | 文献 |
|---|---|---|---|---|---|
| 共沉淀法 | LiNi0.7Mn0.3O2 | 500 ℃预烧结5 h | 900 ℃退火15 h | 20 h | [34] |
| 溶胶凝胶法 | LiNi0.9Mn0.1O2 | 200 ℃分解4 h,500 ℃煅烧3 h | 800 ℃退火5 h | 12 h | [19] |
| 熔盐法 | LiNi0.7Mn0.3O2 | 850 ℃反应8 h | 洗涤、抽滤、干燥 | > 8 h | [20] |
| 微波辅助法 | LiNi0.8Mn0.2O2 | 550 ℃反应5 h | 780 ℃退火12 h | 17 h | [21] |
| FASP | LiNi0.8Mn0.2O2 | 燃烧过程毫秒级 | 800 ℃退火8 h | 8 h | 本文 |
1 实验部分
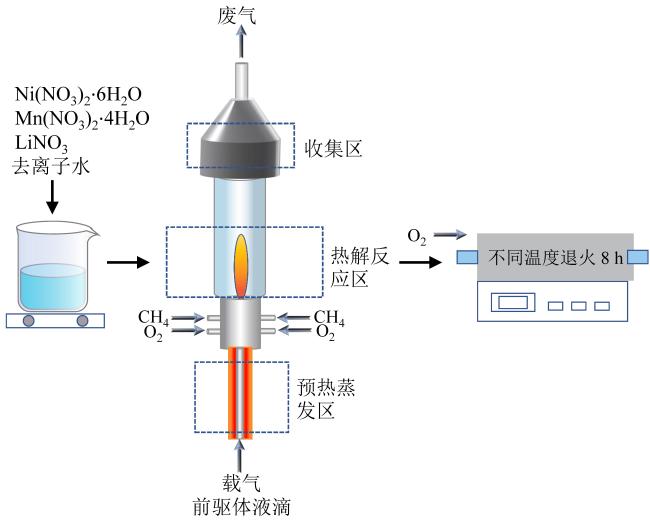
1.1 材料制备
Fig. 1 Process schematic diagram of FASP synthesis NM82图1 FASP合成NM82工艺流程示意图 |
1.2 材料表征
1.3 电化学性能测试
2 结果与讨论
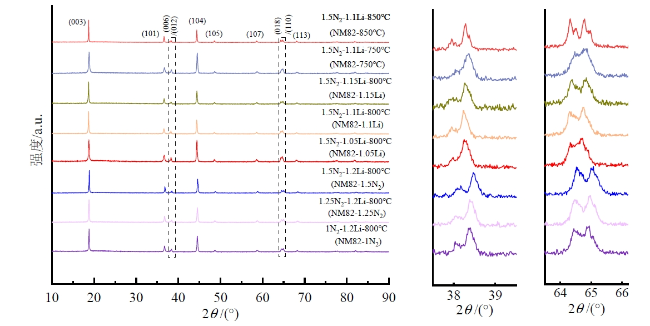
2.1 不同合成条件下材料结构表征
Fig. 2 XRD patterns of NM82 prepared by FASP under different synthesis conditions图2 不同合成条件下FASP制备NM82的XRD图谱 |
Table 2 Lattice parameters of NM82 prepared by FASP under different conditions表2 不同工况下FASP制备的NM82结构参数 |
| 合成条件(命名) | a/Å | c/Å | c/a | I(003)/I(104) | 锂镍混排水平/% |
|---|---|---|---|---|---|
| 1N2-1.2Li-800 ℃(NM82-1N2) | 2.870 9 | 14.193 5 | 4.943 9 | 1.23 | 4.57 |
| 1.25N2-1.2Li-800 ℃(NM82-1.25N2) | 2.872 1 | 14.210 6 | 4.947 8 | 1.21 | 5.08 |
| 1.5N2-1.2Li-800 ℃(NM82-1.5N2) | 2.867 2 | 14.193 3 | 4.950 2 | 1.14 | 5.32 |
| 1.5N2-1.15Li-800 ℃(NM82-1.15Li) | 2.873 6 | 14.214 4 | 4.946 5 | 1.20 | 3.89 |
| 1.5N2-1.1Li-800 ℃(NM82-1.1Li) | 2.871 6 | 14.190 9 | 4.941 8 | 1.20 | 3.50 |
| 1.5N2-1.05Li-800 ℃(NM82-1.05Li) | 2.878 9 | 14.210 2 | 4.936 0 | 1.06 | 9.71 |
| 1.5N2-1.1Li-750 ℃(NM82-750℃) | 2.876 2 | 14.199 6 | 4.936 9 | 1.10 | 8.30 |
| 1.5N2-1.1Li-850 ℃(NM82-850℃) | 2.875 3 | 14.220 9 | 4.945 8 | 1.18 | 4.42 |
2.2 不同合成条件下材料形貌表征
Fig. 3 SEM images of NM82 samples under different carrier gas flow rates: (a, d) 1 L/min; (b, e) 1.25 L/min; (c, f) 1.5 L/min图3 不同载气流速条件下NM82样品的SEM图:(a、d)1 L/min;(b、e)1.25 L/min;(c、f)1.5 L/min |
Fig. 4 SEM images of NM82 samples under different lithium excess conditions: (a, e) 1.05; (b, f) 1.1; (c, g) 1.15; (d, h) 1.2图4 不同锂过量条件下NM82样品的SEM图:(a、e)1.05;(b、f)1.1;(c、g)1.15;(d、h)1.2 |
Fig. 5 SEM images of NM82 samples at different annealing temperatures: (a, d) 750 °C; (b, e) 800 °C; (c, f) 850 °C图5 不同退火温度条件下NM82样品的SEM图:(a、d)750 ℃;(b、e)800 ℃;(c、f)850 ℃ |
Fig. 6 Surface element scanning of NM82-1.1Li material图6 NM82-1.1Li材料表面元素扫描图 |
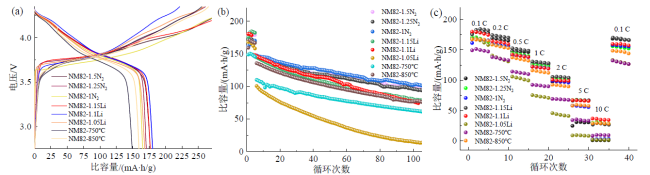
2.3 不同合成条件下电化学性能测试
Fig. 7 Electrochemical performance of NM82 sample prepared under different synthesis conditions: (a) the initial charge and discharge curves at 0.1 C; (b) cycle performance curves at 1 C; (c) rate performance curves图7 不同合成条件制备的NM82电化学性能:(a)0.1 C下初始充放电曲线;(b)1 C下循环性能曲线;(c)倍率性能曲线 |
Table 3 Electrochemical performance of NM82 prepared under different synthesis conditions表3 不同合成条件制备的NM82电化学性能表 |
| 样品 | 初始放电比容量/(mA∙h/g) (0.1 C) | 第1次放电比容量/(mA∙h/g) (1 C) | 第100次放电比容量/(mA∙h/g) (1 C) | 容量保持率/% |
|---|---|---|---|---|
| NM82-1N2 | 161.5 | 147.5 | 101.4 | 68.7 |
| NM82-1.25N2 | 170.6 | 144.7 | 94.0 | 65.0 |
| NM82-1.5N2 | 176.8 | 144.9 | 97.2 | 67.1 |
| NM82-1.15Li | 176.7 | 144.5 | 78.6 | 54.4 |
| NM82-1.1LI | 180.2 | 148.6 | 74.4 | 50.0 |
| NM82-1.05Li | 168.2 | 100.6 | 13.8 | 13.7 |
| NM82-750℃ | 148.9 | 110.1 | 61.5 | 55.9 |
| NM82-850℃ | 159.4 | 135.6 | 76.2 | 56.2 |
Table 4 Performance comparison of LiNi1-xMnxO2 (1-x ≥ 0.6) synthesized by different methods表4 不同方法合成LiNi1-xMnxO2(1-x ≥ 0.6)的性能比较 |
| 制备方法 | 样品 | 前驱体合成时间 | I(003)/I(104) | c/a | 粒径/μm | 放电比容量/(mA∙h/g) | 文献 |
|---|---|---|---|---|---|---|---|
| 共沉淀法 | LiNi0.7Mn0.3O2 | 60 h | 1.24 | — | 7.3 | 176.0(0.1 C) | [41] |
| 溶胶凝胶法 | LiNi0.9Mn0.1O2 | 4 h | 1.14 | 4.938 | — | 202.1(0.1 C) | [19] |
| 熔盐法 | LiNi0.7Mn0.3O2 | — | 1.39 | 4.920 | 0.2 ~ 3.0 | 176.2(0.2 C) | [20] |
| 微波辅助法 | LiNi0.8Mn0.2O2 | 14 h | 1.32 | 4.951 | 8.2 | 195.6(0.2 C) | [21] |
| FASP | LiNi0.8Mn0.2O2 | 毫秒级 | 1.20 | 4.942 | 1.0 ~ 3.0 | 180.2(0.1 C) | 本文 |