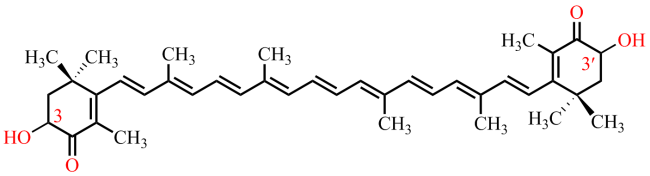
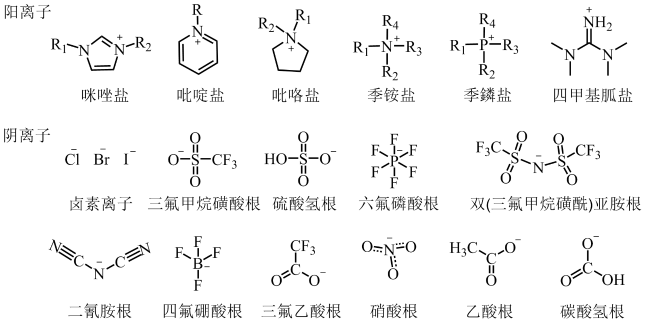
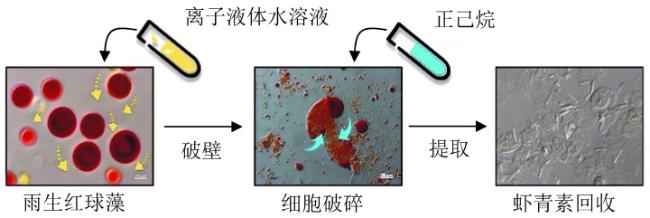
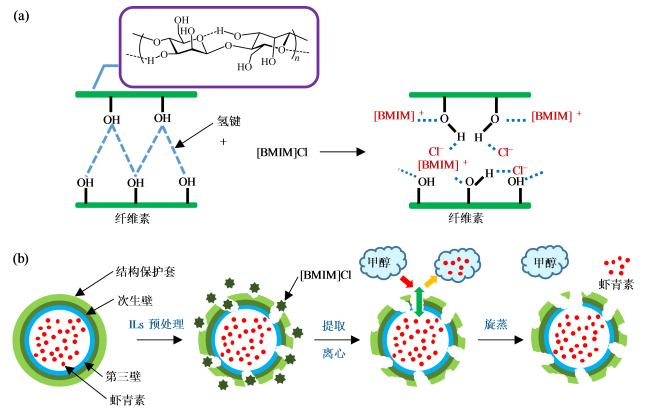
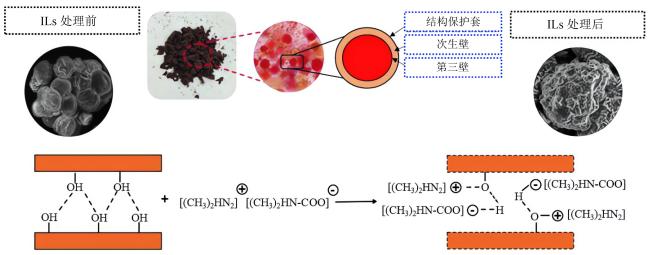
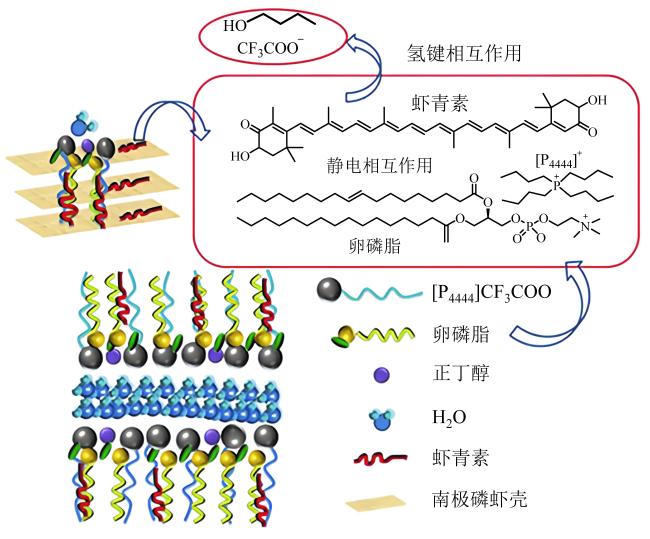
与此同时,为了减少有机溶剂的使用甚至是无有机溶剂参与,构建新型的离子液体-盐液态双相体系也是天然虾青素提取的一种高效、绿色工艺技术
[57,63]。例如GAO等
[57]考察了不同季铵盐(季膦盐)-磷酸钾(K
3PO
4)双水相体系对虾渣中虾青素的提取效果。实验发现,由于 [P
4448]Br-K
3PO
4体系与虾青素之间的键合作用最强,在35 ℃下虾青素提取率可高达93.08%。同时,张莉莉等
[63]构建了六种离子液体-盐双水相体系用于在超声辅助下提取雨生红球藻中的虾青素;其中[P
4448]Br-K
2HPO
4/KH
2PO
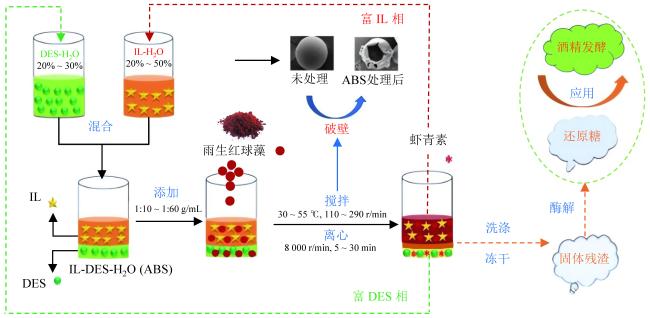
4形成双水相的能力及其对虾青素的提取效果均为最强,其提取率高达96.09%。此外,他们还研究了双水相体系相行为和生物分子迁移特性之间的关系。随后,他们又研究了由离子液体和深共晶溶剂(deep eutectic solvents, DESs)组成的新型双水相体系(aqueous biphasic systems, ABSs)选择性提取雨生红球菌中的虾青素(
图7)
[58]。结果表明,由于存在较强的氢键相互作用、范德华力和空间位阻效应等因素,其中以 [P
4448]Cl和果糖-氯化胆碱([ChCl][Fru])为原料制备的ABSs提取性能最佳,其虾青素提取率达81.27%。此外,[P
4448]Cl-[ChCl][Fru]新型双水相体系在连续3次循环实验后,仍具有良好的萃取性能。同时,与有机溶剂提取法相比,该ILs-DESs双水相体系选择性提取天然虾青素具有更高效、可循环、绿色环保等优点。